
| n |
| V |
| 160g |
| 40g/mol |
| 4mol |
| 1L |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
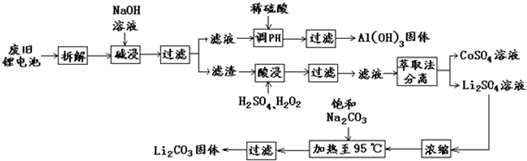
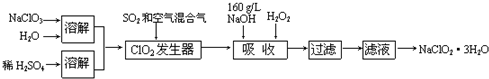
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
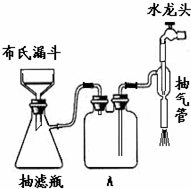
科目:高中化学 来源: 题型:
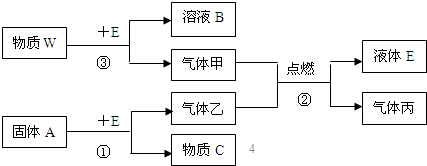
查看答案和解析>>
科目:高中化学 来源: 题型:
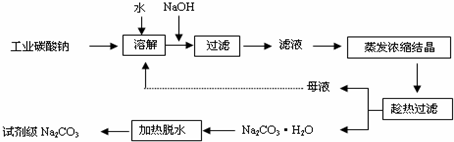

查看答案和解析>>
科目:高中化学 来源: 题型:
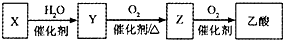 某石油化工产品X的转化关系如图,下列判断正确的是( )
某石油化工产品X的转化关系如图,下列判断正确的是( )| A、X与H2O生成Y的反应是加成反应 |
| B、1 mol Y与足量金属钠反应,能生成3 mol H2 |
| C、Z与CH3OCH3互为同分异构体 |
| D、0.1 mol?L-1乙酸溶液pH为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
| B、检验NH4+时,向试样中加入NaOH溶液并加热,用湿润红色石蕊试纸检验逸出的气体 |
| C、用分液漏斗滴加溶液时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔 |
| D、玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com