
(15分)
某学习小组利用某工业废弃固体(主要成分为Cu2S和Fe2O3)来研究相关物质的制备。设计方案如图所示:
已知:Ksp[Cu(OH)2]=6.0×10-20 ,Ksp[Fe(OH)2]=1.6×10-14 ,Ksp[Fe(OH)3]=1.0×10-38
(1) 废弃固体在空气中灼烧发生反应(有2种元素被氧化)的化学方程式为______。
(2) 溶液C通过_______、_________、过滤等操作得到Fe2(SO4)3晶体。
(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和 。溶液D在这一过程中所起的作用是_______。
(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 ,溶液的pH至少调节为________。
(1)Cu2S + 2O2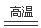 2CuO + SO2 (2)蒸发浓缩;冷却结晶
2CuO + SO2 (2)蒸发浓缩;冷却结晶
(3)Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4;催化剂 (4)CuO(或Cu(OH)2、CuCO3等);3
解析试题分析:(1) 在废弃固体中Fe2O3已经是最高价氧化物,不能再发生反应,而Cu2S在空气中灼烧会发生反应产生SO2和CuO。反应的化学方程式为Cu2S + 2O2 2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
考点:考查化学反应原理、混合物的分离方法、沉淀溶解平衡的应用的知识。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:单选题
FeCl3溶液、Fe(OH)3胶体共同具备的性质是
| A.都呈透明的红褐色 |
| B.分散质颗粒直径相同 |
| C.都比较稳定,密封保存一段时间都不会产生沉淀 |
| D.都能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列生产工艺能体现“绿色化学”或节能环保思想的是( )
| A.工业制氢气:用天然气发电再电解水制得 |
| B.工业制硫酸:提高尾气排放的烟囱高度 |
| C.工业制胆矾:使用向稀硫酸中吹空气并加热溶解铜 |
| D.降低PM2.5:用油改煤技术,推广优质煤的使用范围 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(11分)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示: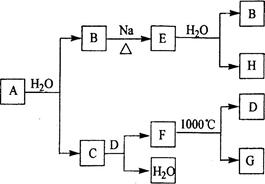
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为______ _ ______;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______ ______ (填化学式);
(4)如何由F制备A : 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。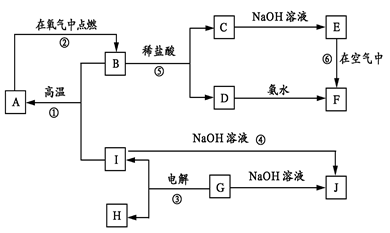
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质C、G的化学式:C ,G 。
(3) 写出反应①、④的化学方程式:反应①: 。反应④: 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(7分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。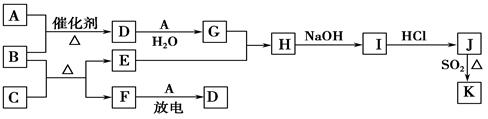
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1) F的组成元素在元素周期表中的位置______________。
(2) B和C反应的化学方程式为_____________________________。
(3) E与G的稀溶液反应的离子方程式为______________________。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):
阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH-、Cl-、CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
请回答下列问题:
(1)写出A与D的化学式: A______________,D_______________。
(2)写出A与E溶液反应的离子方程式:____________________________________。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-akJ·mol-1.请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式:________________。
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是_______________;将C与醋酸混合,醋酸的电离程度将____________(填“增大”“不变”或“减小”)(水的浓度视为常数).
(5)用惰性电极电解0.1mol·L-1 D与0.1mol·L-1C各100mL混合后的溶液,电解一段时间后,阴极质量_________(填“增大”“不变”或“减小”,下同);溶液的pH____________.
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)某有机物X(C13H14O8)分子中含有多种官能团,其结构为(其中I、II为未知部分的结构):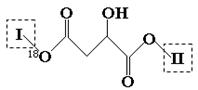
为推测X的分子结构,现进行如图所示的转化。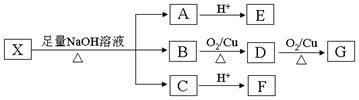
已知:①E分子中检测到18O原子,向E的水溶液中滴入FeCl3溶液显紫色,E的核磁共振氢谱中有4组峰,且峰面积之比为1︰2︰2︰1,E与NaHCO3反应有CO2产生;②G的分子式为C2H2O4。请回答下列问题:
(1)E分子所含官能团的名称是 _________________ ;X溶液遇FeCl3溶液不显紫色,则X的结
构简式为 __________________________________ 。
(2)写出B与G反应生成M(分子内含有六元环)的化学方程式:_____________________ 。
(3)F有特殊愉快的酸味,可作为食品饮料的添加剂;F的聚合物具有良好的生物相容性,可作为手术缝合线等材料广泛应用于生物医药和生物材料领域。由B经过下列途径可合成F:
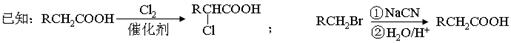
①N→T的反应类型是 __________ ,N的结构简式是 _____________ 。
②写出T→F的第一步反应的化学方程式:___________________________________ 。
(4)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:_____________ 。
①属于芳香族化合物;②能发生银镜反应;③苯环上的一氯代物只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com