
【题目】含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为____。
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N_____O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为____;
②钴离子周围配位键数目(配位数)是 ___;N03-的空间构型为____;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是____。
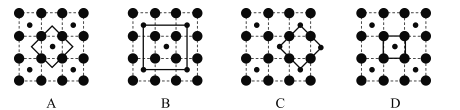
(3)某钴氧化物品体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是_____
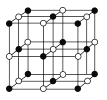
(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 ___填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为____;在该钴的氧化物品体中原子的空间利用率为____(均用含a、b的计算表达式表示)。
【答案】 ![]() 大于 sp3 6 平面(正)三角形 含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+ D 正八面体
大于 sp3 6 平面(正)三角形 含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+ D 正八面体 ![]()
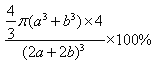
【解析】(1)钴价电子为9,基态Co3+的价电子排布图为![]() ;(2)①氮的3P处于半充满状态,第一电离能N大于O;两种配位原子的杂化轨道类型均为sp3 ;②钴离子周围上下左右前后位置有氧原子,配位键数目(配位数)是6;氮形成3个δ键,sp2杂化,N03-的空间构型为平面(正)三角形 ;③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+;(3)CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:A中Co、O原子数目之比为1:4×1/2=1:2,符合,B中Co、O原子数目之比为(1+4×1/4):4=1:2,符合,C中Co、O原子数目之比为4×1/4:4×1/2=1:2,符合,D中Co、O原子数目之比为1:4×1/4=1:1,不符合,故选D。(4)钴原子填在氧原子的正八面体的空隙里,钴原子与跟它次近邻的氧原子之间的距离为
;(2)①氮的3P处于半充满状态,第一电离能N大于O;两种配位原子的杂化轨道类型均为sp3 ;②钴离子周围上下左右前后位置有氧原子,配位键数目(配位数)是6;氮形成3个δ键,sp2杂化,N03-的空间构型为平面(正)三角形 ;③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+;(3)CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:A中Co、O原子数目之比为1:4×1/2=1:2,符合,B中Co、O原子数目之比为(1+4×1/4):4=1:2,符合,C中Co、O原子数目之比为4×1/4:4×1/2=1:2,符合,D中Co、O原子数目之比为1:4×1/4=1:1,不符合,故选D。(4)钴原子填在氧原子的正八面体的空隙里,钴原子与跟它次近邻的氧原子之间的距离为![]() pm;每个晶胞中含有的Co原子为:8×1/8+6×1/2=4,O为12×1/4+1=4,4个Co和O原子的体积为
pm;每个晶胞中含有的Co原子为:8×1/8+6×1/2=4,O为12×1/4+1=4,4个Co和O原子的体积为![]() ×4,晶胞的体积:(2a+2b)3,在该钴的氧化物品体中原子的空间利用率为
×4,晶胞的体积:(2a+2b)3,在该钴的氧化物品体中原子的空间利用率为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG) 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成气制备二甲醚:
②CO(g) +2H2(g)![]() CH3OH(g) △H2=- 90.7 kJ/mol
CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)![]() CH3OCH3(g) +H2O(g) △H3
CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
化学键 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |
△H3=_______kJ/mol。
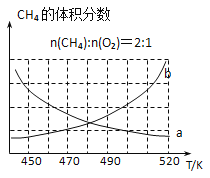
(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______。下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是______;可逆反应③的平衡常数K=_______。若在500K 时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v ( 正)______v (逆),说明原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标况下11.2L 甲醇所含共价键数为5NA
B. 1L 1mol/L葡萄糖溶液含有氧原子数为6NA
C. 46g乙醇在金属铜催化下完全反应生成乙醛转移电子数为2NA
D. 0.1L 12mol/L 浓硫酸与足量Zn完全反应标况下生成气体1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的说法正确的是( )
A.元素化合价升高的反应是还原反应
B.物质在反应中失去了电子,此物质中的某一元素化合价降低
C.有电子转移的反应就是氧化还原反应
D.有化合价升降的反应,不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com