
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
【答案】D
【解析】H2CO3属于二元弱酸,分步电离,以第一步为主:H2CO3![]() H++HCO3-,HCO3-
H++HCO3-,HCO3-![]() H++ CO32-,不能一步写出;A错误;由表可以知道
H++ CO32-,不能一步写出;A错误;由表可以知道![]() 的二级电离大于
的二级电离大于![]() 的一级电离,所以酸性强弱顺序:H2SO3 >HSO >H2CO3>HCO;B错误;Na2CO3溶液水解显碱性,水解过程如下:CO32-+H2O
的一级电离,所以酸性强弱顺序:H2SO3 >HSO >H2CO3>HCO;B错误;Na2CO3溶液水解显碱性,水解过程如下:CO32-+H2O![]() HCO3-+OH-, HCO3-+H2O
HCO3-+OH-, HCO3-+H2O![]() H2CO3+ OH-;根据水解规律可知离子浓度大小顺序为:c(Na+)>c(CO
H2CO3+ OH-;根据水解规律可知离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(OH-)>c(HCO)>c(H+),C错误;由表可以知道 H2SO3的酸性大于 H2CO3的酸性,所以反应的主要离子方程式为
)>c(OH-)>c(HCO)>c(H+),C错误;由表可以知道 H2SO3的酸性大于 H2CO3的酸性,所以反应的主要离子方程式为![]() ↑
↑![]() , 或SO2+HCO==HSO+CO2,D正确;正确选项D。
, 或SO2+HCO==HSO+CO2,D正确;正确选项D。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】据报道,我国钒电池研究获得重大突破,未来十年市场有望突破1000亿美元。某钒电池反应为2VCl2+BrCl2— ![]() 2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
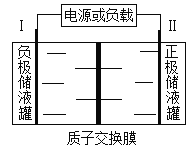
A. 放电时,I极的电极反应式为VCl2—e—+Cl—= VCl3
B. 放电时,H+由交换膜右侧向左侧迁移
C. 充电时,I极与电源负极相连,发生还原反应
D. 充电时,Ⅱ极的电极反应式为2Cl—+Br——2e—= BrCl2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO 及少量的FeO、Fe2O3) 生产氯化铜晶体的流程如下:
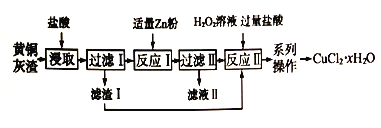
(1)反应I中所加Zn 粉不能过量的原因是_____________。
(2)滤液I中含有的主要金属阳离子是_____________。
(3) 写出反应II 的化学方程式_____________。
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、______、_____。
(5) 在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是_____________。
(6) 298K 时,向c (Cu2+) =0.02mol/L的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Cu2+是否沉淀完全? _____{列式计算,己知:Ksp[Cu(OH)2] =2.2×10-20,c(Cu2+)<1×10-5mol/L 视为沉淀完全}_____。
(7) CuCl2·xH2O晶体中x值的测定:称取3.420 g 产品溶解于适量水中,向其中加入含AgNO34.400×10-2mol 的AgNO3溶液(溶液中除Cl- 外,不含其他与Ag+反应的离子),待C1-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L 的KSCN 标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN 白色沉淀的形式析出。
①滴定终点的现象是__________。
②若滴定过程用去上述浓度的KSCN 标准溶液20.00mL,则CuCl2·xH2O中x值为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 环己烷与苯可用酸性KMnO4溶液鉴别
B. 淀粉和纤维素互为同分异构体
C. 植物油氢化过程中发生了加成反应
D. 水可以用来分离溴苯和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:

(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。

(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为____。
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N_____O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为____;
②钴离子周围配位键数目(配位数)是 ___;N03-的空间构型为____;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是____。
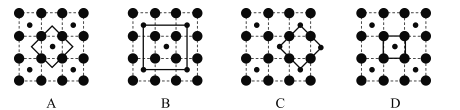
(3)某钴氧化物品体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是_____
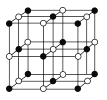
(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 ___填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为____;在该钴的氧化物品体中原子的空间利用率为____(均用含a、b的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
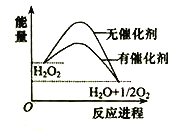
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含___________ 个硫原子,___________mol氧原子。
(2)标准状况下,①1.7g氨气、②3.36 L甲烷、③6.02×1022个二氧化碳分子,含原子数最多的是(填序号,下同)________,质量最大的是_________。
(3)9g某二价金属的氯化物ACl2中含有0.2mol Cl-离子,则ACl2的摩尔质量___________;
(4)某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
①该气体在标准状况下的体积为__________L;
②该气体的一个分子的质量为__________ g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )
A.升高温度
B.改用50mL2mol/L盐酸
C.改用200mL1mol/L盐酸
D.用等量铁粉代替铁片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com