
【题目】(1)1mol H2SO4中含___________ 个硫原子,___________mol氧原子。
(2)标准状况下,①1.7g氨气、②3.36 L甲烷、③6.02×1022个二氧化碳分子,含原子数最多的是(填序号,下同)________,质量最大的是_________。
(3)9g某二价金属的氯化物ACl2中含有0.2mol Cl-离子,则ACl2的摩尔质量___________;
(4)某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
①该气体在标准状况下的体积为__________L;
②该气体的一个分子的质量为__________ g;
【答案】NA(6.02×1023) 4 ② ③ 90g/mol 22.4m/M M/NA
【解析】
(1)根据硫酸的化学式可知1mol H2SO4中含1mol硫原子,即NA个硫原子,4mol氧原子。
(2)标准状况下,①1.7g氨气的物质的量是1.7g÷17g/mol=0.1mol,②3.36 L甲烷的物质的量是3.36g÷22.4L/mol=0.15mol,③6.02×1022个二氧化碳分子的物质的量是0.1mol,三种物质含有的原子的物质的量分别是0.4mol、0.75mol、0.3mol,因此含原子数最多的是甲烷。三种物质的质量分别是1.7g、0.15mol×16g/mol=2.4g、0.1mol×44g/mol=4.4g,因此质量最大的是二氧化碳。
(3)9g某二价金属的氯化物ACl2中含有0.2molCl-离子,则ACl2的物质的量是0.2mol÷2=0.1mol,则根据M=m/n可知摩尔质量为9g÷0.1mol=90g/mol;
(4)①该气体的物质的量是![]() ,在标准状况下的体积为
,在标准状况下的体积为![]() L;
L;
②该气体的摩尔质量为M g/mol,即1mol该气体的质量是M g,所以一个分子的质量为M/NA g。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质,并测定其结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量固体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)Y的电子式为___________。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为______________。
实验(二):探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。
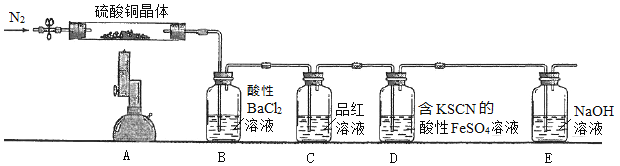
已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有________________________________。
(4)B、C装置的位置不能互换的原因是_______________________________。
(5)D中的反应分两步进行,写出第一步反应的离子方程式___________________________。
实验(三):测定硫酸铜晶体中结晶水的含量。
取wg硫酸铜晶体(CuSO4·xH2O)配成250 mL 溶液,取25.00 mL 溶液用c mol/L EDTA溶液(简写成Y4—)滴定至终点,消耗EDTA标准液V mL。
已知:滴定方程式为:Cu2++ Y4—=CuY2—。
(6)x=___________________(用代数式表示)。
(7)下列情况会使测得的x偏小的是_______(填番号)
a、样品失去部分结晶水
b、量取待测液前未用待测液润洗滴定管
c、开始读数时滴定管尖嘴有气泡而终点时无气泡
d、滴定开始时平视、滴定终点时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的说法正确的是( )
A.元素化合价升高的反应是还原反应
B.物质在反应中失去了电子,此物质中的某一元素化合价降低
C.有电子转移的反应就是氧化还原反应
D.有化合价升降的反应,不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于可逆反应的是( )
A.Cl2与水反应
B.水电解生成H2 和H2在O2中燃烧生成水的相互转化过程
C.工业合成氨
D.氨气与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物广泛存在于自然界中,回答下列问题:
(1)基态氮原子核外有________种不同运动状态的电子,其价层电子排布图为_______________
(2)NH4NO3中元素的第一电离能大小关系:N_______ O,NO3-的空间构型为___________,NH4+中氮原子的杂化类型为_________
(3)HCN分子中含______个σ和________个π键。与CN-互为等电子体的分子和离子分别为______和______(各举一例,填化学式)
(4)NH3极易溶于水,其主要原因是__________________________________________________________________
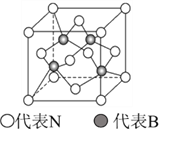
(5)立方氮化硼的结构与金刚石相似,其晶胞如图所示,B原子周围最近的N原子所构成的立体图形为_________,一个晶胞中N原子数目为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2﹣离子核外有a个电子,b个中子,则该微粒X原子可表示为( )
A.a+b+2a+2 X
B.a+b﹣2a﹣2 X
C.b﹣2a+2 X
D.ba X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com