
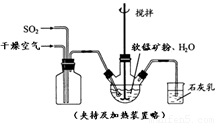
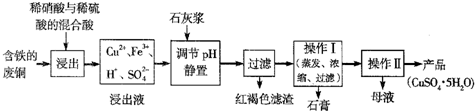
ij��ѧС����ʵ����ģ�������̿���Ҫ�ɷ�MnO2������Ϊ����ͭ�Ļ�����ȣ��Ʊ��ߴ�̼���̣��������£����ֲ����������ԣ���
�� ��������ƿ�У���ͼ��ͨ�������������С����̡���������Ҫ��Ӧԭ��Ϊ��
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
��������������SO2 �ὫFe3+��ԭΪFe2+��
�� ���̡����������ƿ�м���һ������MnO2��ĩ��
�� ����Na2CO3��Һ����pHΪ3.5���ң����ˡ�
�� ������ҺpHΪ6.5��7.2 ������NH4HCO3 ����dz��ɫ�ij������ɣ����ˡ�ϴ�ӡ�����õ��ߴ�̼���̡�
�ش�
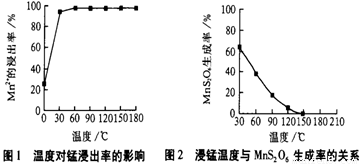
��1�������̡���Ӧ�������и�����MnS2O6 �����ɣ��¶ȶԡ����̡���Ӧ��Ӱ������ͼ��Ϊ����MnS2O6 �����ɣ������̡��������¶��� ��
��2�����ı�1�����е�pHΪ3.5ʱ��������Ҫ�ɷ��� �����м���һ������MnO2��ĩ����Ҫ������ ����Ӧ��Ӧ�����ӷ���ʽΪ ��
��1��������Ӧ���������pH
|
���� |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
|
��ʼ����pH |
2.7 |
7.6 |
8.3 |
4.7 |
|
��ȫ����pH |
3.7 |
9.6 |
9.8 |
6.7 |
��3���������õ���Һ�к���Cu2+�������ӹ��������ܵ����MnS��ȥCu2+�������ˣ��õ�������MnSO4����ƽ���ƶ�ԭ�����ͼ���MnS������_________________��
��4�����м���NH4HCO3 ������Ӧ�����ӷ���ʽ��____________________��
��5��������г����Ƿ�ϴ�Ӹɾ��ķ����� ��
��12�֣�
��1��150�� ����150�����ϣ���1�֣�
��2�� Fe(OH)3 ��1�֣�
��Fe2+����ΪFe3+ ����������SO2������ȥ��2�֣�
MnO2��2Fe2+��4H+=Mn2+��2Fe3+��2H2O �� MnO2+SO2 = Mn2+ + SO42- ��2�֣�
��3��MnS(s) Mn2+(aq)+S2-(aq)
Mn2+(aq)+S2-(aq)
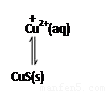
���ɵ�CuS��MnS�����ܣ��ٽ�MnS�����ܽ⣬ƽ�����ƣ�ʹCu2+��ȥ����2�֣�
��4��Mn2����2HCO3����MnCO3����CO2����H2O ��2�֣�
��5��ȡ�������һ��ϴ�Ӻ����Һ�����Թ��У��μ��ữ��BaCl2��Һ�����ް�ɫ���������������ϴ�Ӹɾ�����֮��δϴ�ɾ�����2�֣��������𰸺��������֣�
��������
�����������1������ͼ1��ͼ2��150������ʱ��������MnS2O6 �������� �ͣ�Mn2�� �Ľ����ʸߣ��𰸣�150�� ����150�����ϣ���1�֣�
��2��pH��2.7��3.5֮��ʱ������Ҫ�ɷ���Fe(OH)3 ���𰸣�Fe(OH)3 1�֣�
Fe2�� ��pHΪ7.6��9.6֮�����������ʱMn2�� Ҳ���������������룬��Ҫ��Fe2�� ������Fe3�� �Ա���pHС��8.7ʱ��������Mn2�� ���룬�ʴ𰸣���Fe2+����ΪFe3+ ����������SO2������ȥ��2�֣�
MnO2��2Fe2+��4H+=Mn2+��2Fe3+��2H2O �� MnO2+SO2 = Mn2+ + SO42- ��2�֣�
��3��Cu2�� ��MnS Mn2����CuS,������ת�������ܽ�Ƚϴ��MnSת��Ϊ�ܽ�Ƚ�С��CuS,ԭ�����𰸡��𰸣�
Mn2����CuS,������ת�������ܽ�Ƚϴ��MnSת��Ϊ�ܽ�Ƚ�С��CuS,ԭ�����𰸡��𰸣�
MnS(s) Mn2+(aq)+S2-(aq)
Mn2+(aq)+S2-(aq)
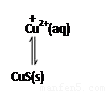
���ɵ�CuS��MnS�����ܣ��ٽ�MnS�����ܽ⣬ƽ�����ƣ�ʹCu2+��ȥ����2�֣�
��4�����м���NH4HCO3 ������Ӧ�IJ���MnCO3���������ӷ���ʽΪ��Mn2����2HCO3����MnCO3����CO2����H2O ���𰸣�Mn2����2HCO3����MnCO3����CO2����H2O ��2�֣�
��5��������г����Ƿ�ϴ�Ӹɾ������Ǽ���ϴ��Һ������SO42�D,��Ϊ��ȡ�������һ��ϴ�Ӻ����Һ�����Թ��У��μ��ữ��BaCl2��Һ�����ް�ɫ���������������ϴ�Ӹɾ�����֮��δϴ�ɾ�����2�֣��������𰸺��������֣�
���㣺Ӧ�û�ѧ��Ӧԭ��������������е�ʵ������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ҺA |
| ��ַ�Ӧ |
| ||
| ��ַ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
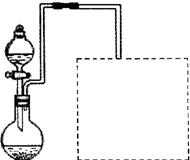
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶�/�� | 800 | 1000 | 1200 | 1400 |
| ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
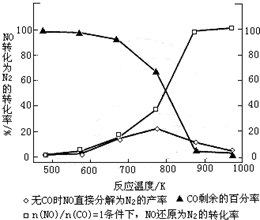
| n(NO) |
| n(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ũ���� |
| �� |

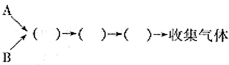
| ���� |
| �� |
| ���� |
| �� |


�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com