
【题目】化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( ) 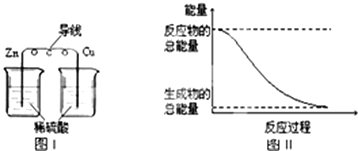
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为吸热反应
【答案】A
【解析】解:A.化学反应时断键要吸收能量,成键要放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故A正确; B.铝热反应为放热反应,所以反应物的总能量比生成物的总能量高,故B错误;
C.图I所示的装置没形成闭合回路,不能形成原电池,没有电流通过,所以不能把化学能转变为电能,故C错误;
D.图II所示的反应,反应物的总能量大于生成物的总能量,所以该反应为放热反应,故D错误;
故选A.
A.化学反应时断键要吸收能量,成键要放出能量;
B.铝热反应为放热反应;
C.图I所示的装置没形成闭合回路,不能形成原电池;
D.图II所示的反应,反应物的总能量大于生成物的总能量.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 自然界中硫是一种淡黄色难溶于水的固体
B. 硫的化合物常存在于火山喷出的气体中和矿泉水里
C. 硫与金属反应,生成金属的低价态化合物
D. 硫在空气中的燃烧产物是二氧化硫,纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为50mL的A、B两份NaOH溶液中,别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如下图所示: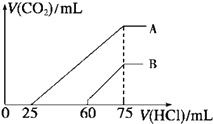
①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是mL(标准状况);
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为物质的量之比为;
③原NaOH溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为醋酸,且a=4,那么A溶液中水电离出的氢离子浓度为________mol/ L。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性。则混合溶液中必定有一种离子能发生水解, 该离子为______________(填离子符号);
混合后的溶液中,下列微粒浓度大小关系一定正确的是___________(填序号)。
①c(MOH)>c(M+)>(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+) >c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
Ⅱ.难溶电解质的溶解平衡属于化学平衡的一种。
(1)已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈_______性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将________(填“增大”、“减小”或“不变”)。
Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈_______性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将________(填“增大”、“减小”或“不变”)。
(2)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:先加入FeSO4·7H2O与Cr2O72-反应生成Cr3+、Fe3+,然后调节pH,使之生成Cr(OH)3、Fe(OH)3。欲使10 L该废水中的Cr2O72-完全转化为Cr3+,则理论上需要加入_________g FeSO4·7H2O。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为_________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJmol﹣1
BaS(s)=Ba(s)+S(s)△H=+460kJmol﹣1
已知:2C(s)+O2(g)=2CO(g)△H=﹣221kJmol﹣1则Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= .
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3﹣=2H3AsO4+3S+10NO2↑+2H2O,当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 .
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS﹣、S2﹣)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).①含硫物种B表示 . 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母).
a.c(Na+)=c(H2S)+c(HS﹣)+2c(S2﹣)
b.2c(Na+)=c(H2S)+c(HS﹣)+c(S2﹣)
c.c(Na+)=3[c(H2S)+c(HS﹣)+c(S2﹣)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示).
(4)硫的有机物( ![]() )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O. ![]() 及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为 ![]() 的核磁共振氢谱图.写出X的结构简式: .
的核磁共振氢谱图.写出X的结构简式: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示,下列说法中正确的是( )

A. 图中A、B、D三点处KW间的关系:B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中c(NH4+)/c(NH3H2O)减小,充分反应后,溶液到达B点
C. 温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D. 加热浓缩A点所示溶液,可从A点变化到B点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室中制备气体或验证气体性质的装置图.
(1)仪器a的名称是 .
(2)利用上图装置制备纯净、干燥的氯气.①圆底烧瓶内发生反应的离子方程式为 .
②装置C中的溶液为;B溶液的作用为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 5KCl+KClO3+3H2SO4=3K3SO4+3Cl2+3H2O,下列说法不正确的是( )
A.KClO3在反应中被还原
B.被还原与被氧化的氧元素的质量比为1:5
C.H2O4在反应中既没被氧化也没被还原
D.生成1mol Cl2时有2mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com