
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
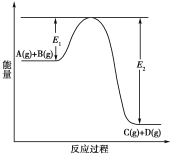
(1)该反应是________反应(填“吸热”或“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”)
(3)反应体系中加入催化剂对反应热是否有影响?___________________________________(填“有”、或“无”)
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
【答案】放热减小无减小减小
【解析】
(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故反应为放热反应,因此,本题正确答案是:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,因此,本题正确答案是:减小;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,但催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以对该反应的反应热无影响;
因此,本题正确答案是:无影响;催化剂不改变反应物总能量与生成物总能量之差;
(4)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化都减小,
因此,本题正确答案是:减小;减小;催化剂改变了反应的途径,降低了反应所需的活化能;


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】南昌西汉海昏侯墓考古发现震惊全国,在打开内棺时,为了防止丝织品被氧化,需要充入一定的保护气体,这种气体是( )
A. H2 B. CO C. SO2 D. N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随PH的变化如图所示。下列叙述错误的是
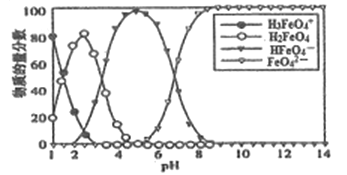
A. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4、K3=5.0×10-8.当pH=4时,溶渡中c(HFeO4-)/c(H2FeO4)=1.2
B. 向pH=5的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
C. PH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
D. 为获得尽可能纯净的高铁酸盐,应控制PH≥9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
H2(g)+![]() O2(g)===H2O(g);ΔH=-241.8 kJ/mol
O2(g)===H2O(g);ΔH=-241.8 kJ/mol
H2(g)+![]() O2(g)===H2O(l);ΔH=-285.8 kJ/mol
O2(g)===H2O(l);ΔH=-285.8 kJ/mol
则氢气的燃烧热为
A. 438.6 kJ/mol B. 241.8 kJ/mol C. 285.8 kJ/mol D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是

A.起始滤液常温下pH=7 B.试剂Ⅰ为Ba(NO3)2溶液
C.上图过程须经2次过滤 D.步骤③目的是除去CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是 ( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
D.催化剂不能改变平衡常数的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g)= 2H2O(g) ΔH=-bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如下图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。
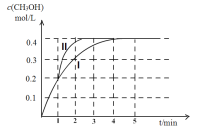
(3)在恒压的条件下,下列选项能说明CO2+3H2![]() CH3OH+H2O反应已达平衡状态的是______。
CH3OH+H2O反应已达平衡状态的是______。
A、ν正(H2): ν逆(CH3OH)=3:1
B、混合气体的密度不再变化
C、混合气的平均摩尔质量不再变化
D、反应中H2O与CH3OH的物质的量浓度之比为1:1,且比值保持不变
(4)在另一温度下发生合成甲醇的反应,关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
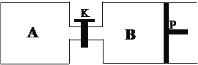
(5)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com