
【题目】麻黄素是中枢神经兴奋剂,其合成路线如下图所示。
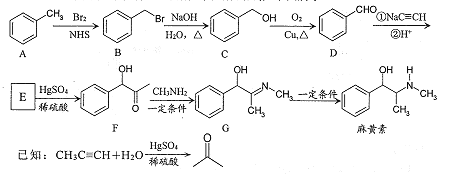
(1)F中的含氧官能团名称为 ____和_____。
(2)E的结构简式为 ____。
(3)写出B→C的化学反应方程式:_______。
(4) F→G历经两步反应,反应类型依次为_____、 ______。
(5)请写出同时满足下列条件的F的一种同分异构体的结构简式_____。
①能发生银镜反应;②水解产物能与FeCl3显色:③核磁共振氢谱显示有四组峰。
(6)请写出以乙醇为原料制备强吸水性树脂![]() 的合成路线流程图(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)___________________。
的合成路线流程图(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)___________________。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 molL-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )

A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:

资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
Ⅳ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____________。
(2)方案甲中,根据I2的特性,分离操作X的名称是________________。
(3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是_______________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1gH2和4gO2反应放出71.45kJ热量,则氢气的燃烧热为142.9 kJmol﹣1
B.在稀溶液中,H+(aq)+OH﹣(aq)═H2O(1)△H=﹣57.3 kJmol﹣1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量大于57.3kJ
C.HCl和NaOH反应的中和热△H=﹣57.3 kJmol﹣1,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJmol﹣1
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体。该晶体以浓氨水、双氧水、CoCl26H2O、NH4Cl 为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
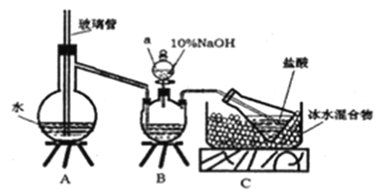
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三预瓶中,然后逐滴加入足量10%NaOH溶液,通入 水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol /L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
步骤二,氯的测定: 准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)装置B中仪器a的名称为_______。
(2)裝置A、B 三脚架处应放置一个酒精灯作为热源,酒精灯应放置在___(填“A”或“B”) 处。
(3) 步骤一所称取的样品中含氮的质量为_______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将____ (填“偏高”、“偏低”或“无影响”); 冰水混合物的作用是________。
(5) 测定氯的过程中,使用棕色滴定管的原因是_______; 出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______ (呈现计算过程)。已知: Ksp(Ag2CrO4)=1.0×10-12 Kp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钻、氮、氯的物质的量之比为1: 6: 3,其中氮元素以氨的形式存在。制备M的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.2gD2中所含的电子的数目为2NA
B.标况下4.48L CHCl3中所含的原子数目为NA
C.4.4g CO2中所含的共用电子对数目为0.2NA
D.14 g乙烯和环己烷( ![]() )的混合物中,所含碳原子数为NA
)的混合物中,所含碳原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
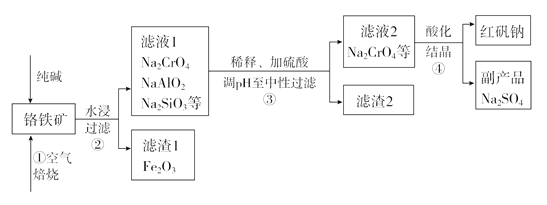
(1)步骤①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”),二氧化硅与纯碱反应的化学方程式为___________。
(2)配平步骤①中主要反应:_________
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2
___Fe2O3+___Na2CrO4+___CO2
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:______________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是___________、____________;
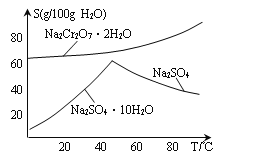
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。
(6)工业上常用电解法处理含Cr2O72-的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_____。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
(7)CrO5的结构式为 ,该氧化物中Cr为_______价。
,该氧化物中Cr为_______价。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)A的官能团的名称是____________。C的结构简式是____________。
(2)E是一种具有香味的液体,由B + D→的反应方程式为:____________。该反应类型是____________。
(3)G是一种高分子化合物,其名称是____________,链节是____________。
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:____________。决定F能用于冷冻麻醉应急处理的性质是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com