
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.几种金属离子沉淀的pH:
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)加入过量硫酸之前先要将铬铁矿矿石粉碎,其目的是________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式_____________。
写出该反应的离子方程式_____________。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
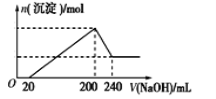
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含铁化合物的物质的量为___________。
【答案】增大反应物的接触面积,加快反应速率,提高浸出率 漏斗、烧杯 3NaBiO3 + Cr2(SO4)3+ 7NaOH+ H2O = 2Na2CrO4 + 3Na2SO4 +3Bi(OH)3 2CrO42-+2H+ ![]() Cr2O72-+H2O 冷却结晶 2.5mol·L-1 0.1mol
Cr2O72-+H2O 冷却结晶 2.5mol·L-1 0.1mol
【解析】
(1)加入过量硫酸之前先要将铬铁矿矿石粉碎,其目的是增大反应物的接触面积,加快反应速率,提高浸出率;综上所述,本题答案是:增大反应物的接触面积,加快反应速率,提高浸出率。
(2)操作I、III、IV均为过滤,则用到的主要玻璃仪器有玻璃棒和漏斗、烧杯;综上所述,本题答案是:漏斗、烧杯。
(3)从流程可以看出:NaBiO3与Cr2(SO4)3在碱性环境下发生氧化还原反应,反应生成Bi(OH)3和Na2CrO4,反应的化学方程式3NaBiO3 +Cr2(SO4)3+7NaOH+ H2O = 2Na2CrO4 +3Na2SO4 +3Bi(OH)3;综上所述,本题答案是:3NaBiO3 +Cr2(SO4)3+7NaOH+H2O = 2Na2CrO4 + 3Na2SO4 +3Bi(OH)3。
(4)在酸性条件下,CrO42-可以部分转化为Cr2O72-,反应的离子方程式:2CrO42-+2H+ ![]() Cr2O72-+H2O ;综上所述,本题答案是:2CrO42-+2H+
Cr2O72-+H2O ;综上所述,本题答案是:2CrO42-+2H+ ![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(5)从溶液中得到晶体的一般操作是:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;经过以上步骤就可以得到红矾钠;综上所述,本题答案是:冷却结晶。
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,说明酸过量,首先发生酸碱中和,当沉淀不再发生变化时需要氢氧化钠是180毫升,继续加入氢氧化钠沉淀开始减小,即氢氧化铝开始溶解,溶解氢氧化铝消耗的氢氧化钠溶液体积是40毫升,则生成氢氧化铝消耗的氢氧化钠溶液的体积是120毫升,所以与铁离子反应的氢氧化钠溶液体积是60毫升,物质的量为0.06×5=0.3mol,根据方程式:Fe3++3OH-=Fe(OH)3↓可知,铁离子的量为0.1mol;根据铁元素守恒可知,固体D中含有铁元素的化合物FeO的物质的量为0.1mol,当沉淀达到最大值时溶液中的溶质是硫酸钠,则根据原子守恒可知硫酸钠的物质的量为0.2×5/2=0.5mol;则硫酸的浓度为0.5/0.2=2.5mol/L;综上所述,本题答案是:2.5mol·L-1 ;0.1mol。


科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,推出图中标记的11种元素,回答下列问题:
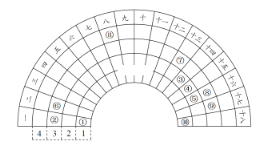
(1)⑤元素形成的简单阴离子的结构示意图为________。
(2)④的气态氢化物的电子式为_____。
(3)在11种元素中,单质的化学性质最不活泼的是_______。(填化学式)
(4)⑧⑨两种元素形成的最高价氧化物的水化物中,酸性较强的是________。(填化学式)
(5)③的单质可以和⑧的最高价氧化物的水化物的浓溶液反应,请写出有关反应的化学方程式____________。
(6)⑦在元素周期表中的位置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某阴离子Rn- 的核外共有x个电子,核内有a个中子,则R的质量数为( )
A. a+x-n B. a+x+n C. a-x-n D. a-x+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝的性质,错误的说法是( )
A.铝的表面能形成致密的氧化膜,因此铝难腐蚀
B.铝能溶解于冷的浓硝酸氧化成为硝酸铝
C.铝能溶解于NaOH溶液生成偏铝酸钠和氢气
D.铝能在氯气中燃烧,生成氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V3 = 19.98 |
3 | 0.0200 | V2 = 23.32 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 常温下,苯是一种无色无味液体,不溶于水
B. 油脂属于高分子化合物,热值较大
C. 葡萄糖溶液中加入银氨溶液,水浴加热有银镜生成
D. 蛋白质遇浓硝酸,微热产生蓝色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com