
����Ŀ��Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣�1��36��Ԫ�أ����Ա���ѧ����Ԫ�����ڱ���˼������Ԫ�����ڱ��������ɣ��Ƴ�ͼ�б�ǵ�11��Ԫ�أ��ش��������⣺
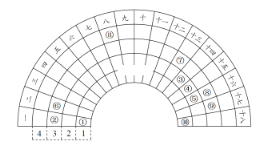
��1����Ԫ���γɵļ������ӵĽṹʾ��ͼΪ________��
��2���ܵ���̬�⻯��ĵ���ʽΪ_____��
��3����11��Ԫ���У����ʵĻ�ѧ��������õ���_______�����ѧʽ��
��4���������Ԫ���γɵ�����������ˮ�����У����Խ�ǿ����________�����ѧʽ��
��5���۵ĵ��ʿ��Ժ͢������������ˮ�����Ũ��Һ��Ӧ����д���йط�Ӧ�Ļ�ѧ����ʽ____________��
��6������Ԫ�����ڱ��е�λ����________��
���𰸡�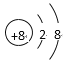
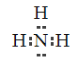 He HClO4 C��2H2SO4��Ũ��
He HClO4 C��2H2SO4��Ũ��![]() CO2����2H2O��2SO2�� �������ڢ�A��
CO2����2H2O��2SO2�� �������ڢ�A��
��������
���ڵ�һ���ڵ�һ�У�����HԪ�أ����ڵ�һ���ڵ�18�У�����HeԪ�أ��ڡ��ޡ��ߡ��ࡢ���ڵ������ڵ�1��2��13��16��17�У��ڡ��ޡ��ߡ��ࡢ��ֱ���Na��Mg��Al��S��ClԪ�أ��ۡ��ܡ��ݷֱ��ڵڶ� ���ڵ�14��15��16�У��ۡ��ܡ��ݷֱ���C��N��OԪ�أ�![]() �ڵ������ڵ�8�У�
�ڵ������ڵ�8�У�![]() ��FeԪ�ء�
��FeԪ�ء�
��1������OԪ�أ��γɵļ��������� O2-��������10�����ӣ����ӽṹʾ��ͼΪ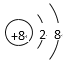 ��
��
��2������NԪ�أ�����̬�⻯���ǰ���������ʽΪ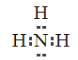 ��
��
��3����11��Ԫ���У�Ԫ��He��ϡ�����壬�ṹ�ȶ������Ի�ѧ��������õ���He��
��4�����ֱ���S��Cl��ͬ����Ԫ�ش����ҷǽ�������ǿ���ǽ�����S<Cl����������Ԫ���γɵ�����������ˮ�����У����Խ�ǿ����HClO4��
��5���۵ĵ�����C������S����Ԫ�ص�����������ˮ���������ᣬ̼��Ũ���ᷴӦ���ɶ�����̼����������ˮ����Ӧ�Ļ�ѧ����ʽ��C��2H2SO4��Ũ��![]() CO2����2H2O��2SO2����
CO2����2H2O��2SO2����
��6������AlԪ�أ���Ԫ�����ڱ��е�λ���ǵ������ڢ�A�塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڻ��Ϸ�Ӧ����
A. Zn +2AgNO3== Zn (NO3)2 + 2Ag B. 2FeCl2 + Cl2 == 2FeCl3
C. Cu(OH)2+ 2HCl == CuCl2+ 2 H 2O D. CaCO3![]() CaO+ CO2��
CaO+ CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ϳ�Ⱦ��X��ҽҩ�м���Y��
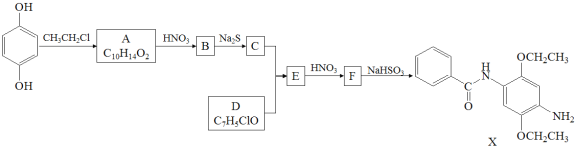
��֪�� ��
��![]()
��ش�
(1)����˵����ȷ����____________��
A��������A����FeCl3��Һ������ɫ��Ӧ B��������C����������
C��������F�ܷ����ӳɡ�ȡ������ԭ��Ӧ D��X�ķ���ʽ��C17H22N2O3
(2)������B�Ľṹ��ʽ��___________________________________________________��
(3)д��C+D��E�Ļ�ѧ����ʽ_____________________________________________________��
(4)д��������A(C10H14O2)ͬʱ��������������ͬ���칹��Ľṹ��ʽ_____________________________��
1H��NMR��IR���������ٷ�������4�ֻ�ѧ������ͬ����ԭ�ӣ��ڷ����к��б�����������(��OCH3)��û���ǻ���������(��O��O��)��
(5)�����CH2=CH2��![]() Ϊԭ���Ʊ�Y(
Ϊԭ���Ʊ�Y(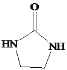 )�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)
)�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)
_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ���һ����;�㷺�Ľ������ϣ������������ںϽ����
A.��B.ͭC.���ʯD.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����÷�Һ©�����з������
A.�Ȼ��ƺ�ˮB.������Ȼ�̼C.ˮ�����Ȼ�̼D.���ͺ�ֲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����
A.1 mol O3������Ϊ 32 gB.SO42����Ħ������Ϊ96 g/mol
C.0.05mol HCl�������1.12LD.0.5mol/L Al2(SO4)3��Һ�к�Al3+�ĸ���ԼΪ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ4Fe(OH)2(s)��2H2O(l)��O2(g)=4Fe(OH)3(s) ��H����444.3kJ/mol���ڳ��³�ѹ�¸÷�Ӧ���Է����У��Է�Ӧ�ķ�����������õ��ǣ� ��
A.�¶�B.ѹǿC.�ʱ�D.�ر�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2������)Ϊ��Ҫԭ����������ԭ�Ϻ췯��(��Ҫ�ɷ�Ϊ:Na2Cr2O7��2H2O)������Ҫ�����������£�

����������ϵ�֪:
i.�����£�NaBiO3������ˮ����ǿ�����ԣ��ڼ����������ܽ�Cr3+ת��ΪCrO42������������ԭΪBi(OH)3������
ii.���ֽ������ӳ�����pH��
���� | ��ʼ������pH | ��ȫ������pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
�ش���������:
(1)�����������֮ǰ��Ҫ���������ʯ���飬��Ŀ����________________________��
(2)����I��III��IV�õ�����Ҫ���������в�������___________�����������ƣ���
(3)д������Ӧ�Ļ�ѧ����ʽ_____________________________________________��
(4)�����ữ��ʹCrO42��ת��ΪCr2O72��![]() д���÷�Ӧ�����ӷ���ʽ_____________��
д���÷�Ӧ�����ӷ���ʽ_____________��
(5)����ҺH�����в���������Ũ����__________�����ˣ�ϴ�ӣ����T�ú췯�ơ�
(6)ȡһ�������Ĺ���D�ܽ���200 mL��ϡ�����У���������Һ�м���5.0 mol/L��NaOH��Һ�����ɳ��������ʵ�����n�������NaOH��Һ�������V����ϵ��ͼ��ʾ����ϡ�����Ũ��Ϊ_________������D�к�������������ʵ���Ϊ___________��
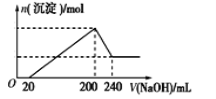
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ(B����ȴװ��δ����)���������Ϳ���(�����뷴Ӧ)�������Լ1��3���ͨ�뺬ˮ8%��̼�������Ʊ�Cl2O������ˮ����Cl2O�Ʊ���������Һ��
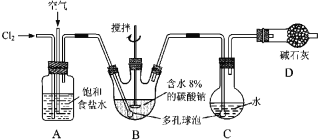
��֪��Cl2O��������ˮ����ˮ��Ӧ����HClO��Cl2O�ķе�Ϊ3.8 ����42 �����Ϸֽ�ΪCl2��O2��
(1)��ʵ���п����������������ȵķ�����________________________________��
��Ϊʹ��Ӧ��ֽ��У�ʵ���в�ȡ�Ĵ�ʩ��______________________________��
��װ��D��������____________________________________��
(2)��װ��B�в���Cl2O�Ļ�ѧ����ʽΪ��____________________________________��
����B����ȴװ�ã������C�е�Cl2O��������١���ԭ����_____________________��
(3)װ��C�в�����ɫԲ����ƿ����Ϊ______________________________________��
(4)��֪������ɱ�H2O2��FeCl2�����ʻ�ԭ��Cl�����ⶨC�д�������Һ�����ʵ���Ũ�ȵ�ʵ�鷽��Ϊ����_____ȡ20.00 mL��������Һ������������_________________���ټ���������_______________�����ˣ�ϴ�ӳ���������ո������и���õ�����ƽ�������������� (��ѡ�õ��Լ���H2O2��Һ��FeCl2��Һ��AgNO3��Һ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com