
【题目】合金是一类用途广泛的金属材料,下列物质属于合金的是
A.钢B.铜C.金刚石D.磁性氧化铁
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】FeCl3,学名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理等。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶物
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_____mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =____________mol/L.
(3)将50mL 0.1mol/L FeCl3和50mL 0.5mol/L CaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为_____mol/L.
(4)芳香族化合物A的分子式为C7H8O,A中加入FeCl3溶液显紫色,且苯环上的一氯代物只有二种,A的结构简式为________,写出A与浓溴水反应的方程式________。
(5)FeCl3可制备氢氧化铁胶体处理污水,处理污水时发生了__________(物理或化学)变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃,,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 1 | 2 | 0 |
平衡浓度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为40%
B. 反应可表示为X(g)+2Y(g) ![]() 2Z(g),其平衡常数为0.74
2Z(g),其平衡常数为0.74
C. 其它条件不变时,增大压强能使平衡向生成Z的方向移动,平衡常数也增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期M、N两种元素对应的简单离子分别为mMa+、n Nb-,若离子的核外电子排布相同,则下列关系不正确的是( )
A. 原子半径:M < NB. 离子半径:M < N
C. 原子序数:M > ND. 主族序数:M < N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,推出图中标记的11种元素,回答下列问题:
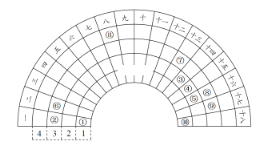
(1)⑤元素形成的简单阴离子的结构示意图为________。
(2)④的气态氢化物的电子式为_____。
(3)在11种元素中,单质的化学性质最不活泼的是_______。(填化学式)
(4)⑧⑨两种元素形成的最高价氧化物的水化物中,酸性较强的是________。(填化学式)
(5)③的单质可以和⑧的最高价氧化物的水化物的浓溶液反应,请写出有关反应的化学方程式____________。
(6)⑦在元素周期表中的位置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某阴离子Rn- 的核外共有x个电子,核内有a个中子,则R的质量数为( )
A. a+x-n B. a+x+n C. a-x-n D. a-x+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V3 = 19.98 |
3 | 0.0200 | V2 = 23.32 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com