
����Ŀ����25 �棬,�ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/(mol��L��1) | 1 | 2 | 0 |
ƽ��Ũ��/(mol��L��1) | 0.6 | 1.2 | 0.8 |
����˵���������( )
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ40%
B. ��Ӧ�ɱ�ʾΪX(g)+2Y(g) ![]() 2Z(g)����ƽ�ⳣ��Ϊ0.74
2Z(g)����ƽ�ⳣ��Ϊ0.74
C. ������������ʱ������ѹǿ��ʹƽ��������Z�ķ����ƶ�,ƽ�ⳣ��Ҳ����
D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
���𰸡�C
��������A��ת������������������ʼ���õ���
B�������������������㷴Ӧ���ʵ���֮��д����ѧ����ʽ��
C����ѧƽ�ⳣ��ֻ���¶ȱ仯��
D������ƽ�ⳣ����С��˵��ƽ��������������������ȷ�Ӧ�������Ƿ��ȷ�Ӧ��
A������ͼ����������֪����X���ĵ����ʵ���Ũ��=1mol/L-0.6mol/L=0.4mol/L��X��ת����=![]() 100%=40%������Aѡ������ȷ����
100%=40%������Aѡ������ȷ����
B��ͼ���з�����������������Ϊ������XŨ��1mol/L-0.6mol/L=0.4mol/L��Y����Ũ��2mol/L-1.2mol/L=0.8mol/L��Z����Ũ��0.8mol/L����Ӧ��ΪX��Y��Z=0.4:0.8:0.8=1:2:2����Ӧ�Ļ�ѧ����ʽΪ��X(g)+2Y(g) ![]() 2Z(g)��ƽ�ⳣ��K=
2Z(g)��ƽ�ⳣ��K=![]() =
=![]() =0.74������Bѡ������ȷ����
=0.74������Bѡ������ȷ����
C����Ӧ���������������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ�������������Z�ķ����ƶ����¶Ȳ�������ƽ�ⳣ����������C������
D������ƽ�ⳣ����С��˵��ƽ��������������������ȷ�Ӧ�������Ƿ��ȷ�Ӧ������Dѡ������ȷ����
�ʱ����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���廯�����ǾۺϷ�Ӧ�г��õ�һ�ִ������׳�����ʣ�800�����Ͽ�����������ʱFeBr3 ����ٷֽ�ΪFeBr2��ijУͬѧ���ʵ���ø����HBr ��Fe ��Ӧ�Ʊ�����FeBr2��ʵ��װ������(���ּг�װ����ʡ��)����ش�������⣺
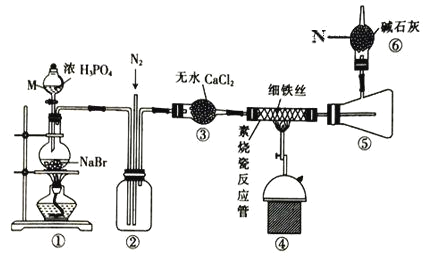
��1������ M ������___��װ�â�����Ҫ�Ļ�ѧ����ʽΪ__________��
��2��װ�â�������___���ݳ���������Ҫ��_____(�ѧʽ)��
��3��ʵ�����ʱҪ�ر���Դ������ͨ��N2һ��ʱ�䣬��ʱͨN2��Ŀ����____��
��4����Ũ���ỻ��Ũ����ͬ�����Ƶ� HBr������Ӧ������Բ����ƿ�ڵ���Һ��Ϊ�Ȼ�ɫ��
��Ũ�����Ũ������������� HBr ��ԭ������������ᶼ����___����ѡ����ĸ����
a����ˮ�� b��ǿ������ c���ѻӷ���
����Һ��Ȼ�ɫ����Ϊ�����˸���Ӧ____(д��ѧ����ʽ)��
��Ũ���ỻ��Ũ����Բ�Ʒ����____ (������������û����)Ӱ�죬������__
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ZnO��ҽҩ��ʯ���������й㷺����;���о�С����ij��п��(��Ҫ�ɷ�ZnS������FeS��SiO2��MnCO3������)�Ʊ�����п�����ʣ������������:
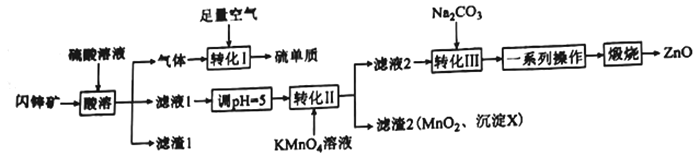
��ش���������:
��1������1�Ļ�ѧʽΪ____________________����дһ�ָ����ʵ���:______________________��
��2������X�Ļ�ѧʽΪ_______________________________��
��3����ת��I�����������ͻ�ԭ�������ʵ���֮��Ϊ________________________��
��4����ת��II������Ҫ��Ӧ�����ӷ���ʽΪ_____________________________________��
��5����Ksp(ZnCO3)=1.5��10-10����Һ������Ũ����1.0��10-5 mol/Lʱ����Ϊ�����ӳ�����ȫ������ʹ1 L c(Zn2+)=1.5 mol/L��Һ��Zn2+������ȫ�������������Na2CO3��Һ�����ʵ���Ũ������Ϊ____________________(�г�����ʽ����Һ���ʱ����仯���Բ���)��
��6����һϵ�в������������ˡ�ϴ�ӡ�����������õIJ���������___________________________��ϴ�ӳ����IJ���Ϊ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ϳ�Ⱦ��X��ҽҩ�м���Y��
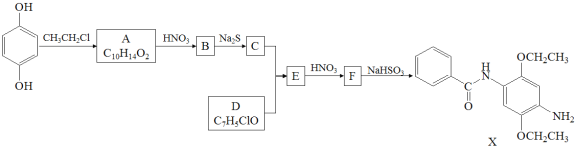
��֪��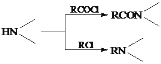 ��
��![]()
��ش�
(1)����˵����ȷ����____________��
A��������A����FeCl3��Һ������ɫ��Ӧ B��������C����������
C��������F�ܷ����ӳɡ�ȡ������ԭ��Ӧ D��X�ķ���ʽ��C17H22N2O3
(2)������B�Ľṹ��ʽ��___________________________________________________��
(3)д��C+D��E�Ļ�ѧ����ʽ_____________________________________________________��
(4)д��������A(C10H14O2)ͬʱ��������������ͬ���칹��Ľṹ��ʽ_____________________________��
1H��NMR��IR���������ٷ�������4�ֻ�ѧ������ͬ����ԭ�ӣ��ڷ����к��б�����������(��OCH3)��û���ǻ���������(��O��O��)��
(5)�����CH2=CH2��![]() Ϊԭ���Ʊ�Y(
Ϊԭ���Ʊ�Y(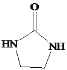 )�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)
)�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)
_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��¿��淴Ӧ��Fe2(SO4)3��6KSCN![]() 2Fe(SCN)3��3K2SO4�ﵽƽ��״̬������������к��ֹ������ʣ���ƽ�⼸���������ƶ�( )
2Fe(SCN)3��3K2SO4�ﵽƽ��״̬������������к��ֹ������ʣ���ƽ�⼸���������ƶ�( )
A. NH4SCN B. K2SO4 C. NaOH D. FeCl3��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ���һ����;�㷺�Ľ������ϣ������������ںϽ����
A.��B.ͭC.���ʯD.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����÷�Һ©�����з������
A.�Ȼ��ƺ�ˮB.������Ȼ�̼C.ˮ�����Ȼ�̼D.���ͺ�ֲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ4Fe(OH)2(s)��2H2O(l)��O2(g)=4Fe(OH)3(s) ��H����444.3kJ/mol���ڳ��³�ѹ�¸÷�Ӧ���Է����У��Է�Ӧ�ķ�����������õ��ǣ� ��
A.�¶�B.ѹǿC.�ʱ�D.�ر�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx����ҪָNO��NO2���Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
��1����ˮ����NOx������Ȼ�ѧ����ʽ���£�
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ��H=116.1 kJ��mol1
HNO3(aq)+HNO2(aq) ��H=116.1 kJ��mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ��H=75.9 kJ��mol1
HNO3(aq)+2NO(g)+H2O(l) ��H=75.9 kJ��mol1
��Ӧ3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)�Ħ�H=___________kJ��mol1��
2HNO3(aq)+NO(g)�Ħ�H=___________kJ��mol1��
��2����ϡ��������NOx���õ�HNO3��HNO2�Ļ����Һ�����û����Һ�ɻ�ý�Ũ�����ᡣд�����ʱ�����ĵ缫��Ӧʽ��________________________________��
��3��������(NH2)2COˮ��Һ����NOx�����չ����д���HNO2��(NH2)2CO����N2��CO2�ķ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��___________________________________��
��4�������������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2����һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д���M�ķ�Ӧ���з�Ӧ��װ�ü���ͼ����
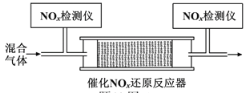
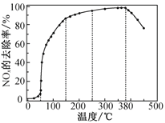
��Ӧ��ͬʱ��NOx��ȥ�����淴Ӧ�¶ȵı仯����������ͼ��ʾ����50��250 �淶Χ�������¶ȵ����ߣ�NOx��ȥ������Ѹ����������Ҫԭ����____________________________������Ӧ�¶ȸ���380 ��ʱ��NOx��ȥ����Ѹ���½���ԭ�������___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com