
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:
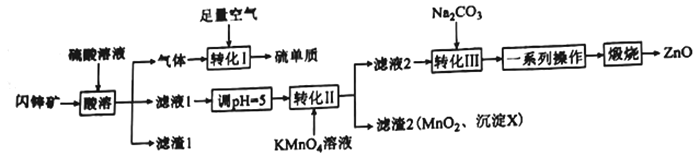
请回答下列问题:
(1)滤渣1的化学式为____________________,任写一种该物质的用:______________________。
(2)沉淀X的化学式为_______________________________。
(3)“转化I”中氧化剂和还原剂的物质的量之比为________________________。
(4)“转化II”中主要反应的离子方程式为_____________________________________。
(5)若Ksp(ZnCO3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol/L时,认为该离子沉淀完全。则欲使1 L c(Zn2+)=1.5 mol/L溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为____________________(列出计算式,溶液混合时体积变化忽略不计)。
(6)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有___________________________;洗涤沉淀的操作为______________________________________________。
【答案】SiO2 制光导纤维、制玻璃、冶炼硅等 Fe(OH)3 1:2 2MnO4-+3Mn2++2H2O==5MnO2↓+4H+、MnO4-+3Fe2++7H2O==MnO2↓+3Fe(OH)3↓+5H+ [1.5mol/L×1L+(1.5×10-10/1.0×10-5)mol/L×2L]/1L 烧杯、漏斗、玻璃棒 用玻璃棒引流向过滤器中加蒸馏水至浸没沉淀,待水自然流下,重复操作2~3次
【解析】
(1)根据题中所给信息分析,SiO2不与硫酸反应,其余物质都可以和硫酸反应,所以滤渣1为SiO2,SiO2可以制光导纤维、制玻璃、冶炼硅等。
(2)滤液1中包含的离子有Fe2+、Zn2+、Mn2+,调pH=5并加入KMnO4会将Fe2+变成Fe(OH)3沉淀,故沉淀X的化学式为Fe(OH)3。
(3)由题意可知转化I的为2H2S+O2=2S+2H2O,氧化剂O2与还原剂H2S的物质的量比为2:1。
(4)转化Ⅱ中KMnO4可以将Mn2+和Fe2+氧化,对应的方程式为2MnO4-+3Mn2++2H2O==5MnO2↓+4H+、MnO4-+3Fe2++7H2O==MnO2↓+3Fe(OH)3↓+5H+
(5)假设体积均为1L,将Zn2+沉淀需要的Na2CO3溶液的物质的量为1.5mol/L×1L,因为Ksp(ZnCO3)=c(Zn2+)×c(CO32-)=1.0×10-5mol/L×c(CO32-)=1.5×10-10,所以c(CO32-)=1.5×10-10/1.0×10-5mol/L,因为是等体积混合,所以这部分Na2CO3溶液的物质的量为(1.5×10-10/1.0×10-5)mol/L×2L,所以碳酸钠溶液的浓度为[1.5mol/L×1L+(1.5×10-10/1.0×10-5)mol/L×2L]/1L。
(6)过滤所用的玻璃仪器有烧杯、漏斗、玻璃棒;洗涤沉淀的操作为:用玻璃棒引流向过滤器中加蒸馏水至浸没沉淀,待水自然流下,重复操作2~3次。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. ![]() 的中子数和质子数之差为115
的中子数和质子数之差为115
B. 浓硝酸显黄色是因为含有Fe3+
C. 二氧化硫和氯气使品红溶液褪色的原理相同
D. 长石(KAlSi3O8)用氧化物形式可表示为K2O·Al2O·6Si02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α丙氨酸是组成人体蛋白的氨基酸之一,如图是α丙氨酸的分子结构模型图,下列对α丙氨酸的叙述不正确的是( )
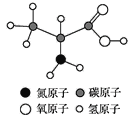
A. α丙氨酸分子由碳、氢、氧、氮四种原子构成
B. α丙氨酸中氧元素的质量分数最大
C. α丙氨酸的分子式为C3H7O2N
D. α丙氨酸与CH3CH2CH2NO2以及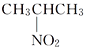 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol某金属单质与足量的盐酸反应,放出67.2L H2(标准状况),并转变为具有Ne原子电子层结构的离子,该金属元素在元素周期表中的位置是
A. 第三周期第ⅠA族B. 第三周期第ⅡA族
C. 第三周期第ⅢA族D. 第四周期第ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃,,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 1 | 2 | 0 |
平衡浓度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为40%
B. 反应可表示为X(g)+2Y(g) ![]() 2Z(g),其平衡常数为0.74
2Z(g),其平衡常数为0.74
C. 其它条件不变时,增大压强能使平衡向生成Z的方向移动,平衡常数也增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com