
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________________________________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见下图)。
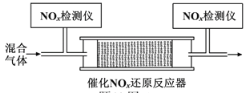
反应相同时间NOx的去除率随反应温度的变化曲线如题下图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。
【答案】 136.2 HNO22e+H2O![]() 3H++NO3 2HNO2+(NH2)2CO
3H++NO3 2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O 迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大 催化剂活性下降;NH3与O2反应生成了NO
2N2↑+CO2↑+3H2O 迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大 催化剂活性下降;NH3与O2反应生成了NO
【解析】(1)将两个方程式编号,应用盖斯定律,解总焓变;
(2)根据电解原理,阳极发生失电子的氧化反应;
(3)HNO2与(NH2)2CO反应生成N2和CO2,根据电子守恒和原子守恒配平;
(4)因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应。
(1)将两个方程式编号,
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1(①式)
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1(①式)
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1 (②式)
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1 (②式)
应用盖斯定律,将(①×3+②)![]() 2得,反应3NO2(g)+H2O(l)
2得,反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=[(-116.1 kJ·mol1)×3+75.9 kJ·mol1]
2HNO3(aq)+NO(g)的ΔH=[(-116.1 kJ·mol1)×3+75.9 kJ·mol1]![]() 2=-136.2kJ·mol1,
2=-136.2kJ·mol1,
故答案为:136.2;
(2)根据电解原理,阳极发生失电子的氧化反应,阳极反应为HNO2失电子生成HNO3,1mol HNO2反应失去2mol电子,结合原子守恒和溶液呈酸性,电解时阳极的电极反应式为:HNO22e+H2O![]() 3H++NO3,
3H++NO3,
故答案为:HNO22e+H2O![]() 3H++NO3;
3H++NO3;
(3)HNO2与(NH2)2CO反应生成N2和CO2,N元素化合价由HNO2中+3价降至0价,N元素的化合价由(NH2)2CO中-3价升至0价,根据得失电子守恒和原子守恒,反应的化学方程式为:2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O,
2N2↑+CO2↑+3H2O,
故答案为:2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O;
2N2↑+CO2↑+3H2O;
(4)因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应,在50~250 ℃范围内,NOx的去除率先迅速上升是催化剂活性随着温度升高增大,与温度升高共同使NOx的去除率迅速增大;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是温度升高催化剂活性下降,NH3与O2反应生成了NO,
故答案为:迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大 ;催化剂活性下降;NH


科目:高中化学 来源: 题型:
【题目】在25 ℃,,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 1 | 2 | 0 |
平衡浓度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为40%
B. 反应可表示为X(g)+2Y(g) ![]() 2Z(g),其平衡常数为0.74
2Z(g),其平衡常数为0.74
C. 其它条件不变时,增大压强能使平衡向生成Z的方向移动,平衡常数也增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X和Y可以形成XY4型化合物,若X的原子序数为a,Y的原子序数为b,则a和b的相互关系不可能是( )
A. a-13 = b
B. a +8 = b
C. b-11 = a
D. b+5 = a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V3 = 19.98 |
3 | 0.0200 | V2 = 23.32 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
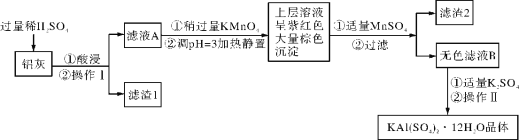
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色。
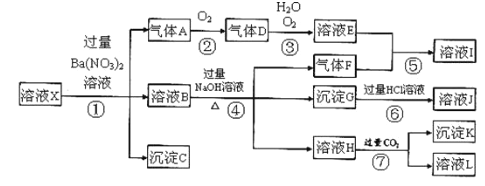
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有___________________________。
(2)溶液X中,关于NO3—的判断一定正确的是_____________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为_________________,并用双线桥表示电子转移的方向和数目。
(4)若转化③中D过量,通常用强碱溶液进行吸收,写出该反应的离子方程式___________________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂可选择___________________。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com