
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
【答案】(1)加快反应(酸溶)速率;避免制备MgCO3时消耗更多的碱或影响Mg2+转化成MgCO3
(2)H2O2+2Fe2++2H+===2Fe3++2H2O
(3)①分液漏斗 ②充分振荡
(4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成或至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至无沉淀生成为止
【解析】试题分析:(1)加热可以加快化学反应速率;如果硫酸过多,则需要消耗更多的减中和硫酸,从而造成生产成本增加。(或影响Mg2+转化成MgCO3。)
(2)滤液中含有Fe2+,加入H2O2将Fe2+氧化为Fe3+,发生发应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(3)①根据仪器A的构造确定其名称为分液漏斗。②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,充分振荡、静置、分液,并重复多次。
(4)根据题给信息知向溶液中加入氨水调节pH不大于8.5,不小于5.0,故由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成或至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至无沉淀生成为止,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是某化学反应过程中能量变化的曲线图。下列有关叙述正确的是( )
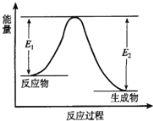
A.该反应为吸热反应
B.该图可以表示Ba(OH)2.8H2O与NH4Cl的反应
C.化学反应中的能量变化只表现为热量的变化
D.化学反应中有旧键断裂就一定有新键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.乙烯使溴的四氯化碳溶液褪色
B.乙烯使酸性KMnO4溶液褪色
C.将苯滴入溴水中,振荡后水层接近无色
D.甲烷与氯气混合,光照后黄绿色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
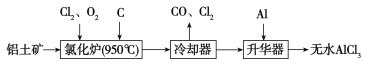
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是
______________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为
_______________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
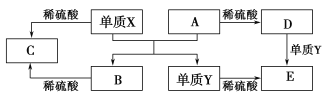
则下列说法正确( )
A.单质X与A反应的化学方程式:Al2O3+2Fe![]() Fe2O3+2Al
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-===Fe(SCN)3↓
C.单质X和单质Y在一定条件下均能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链型的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如图所示(图中的反应式不完整),则下列说法不正确的是( )
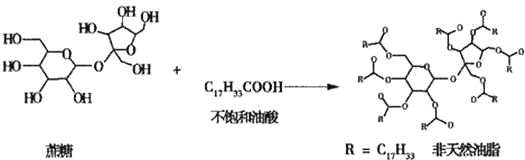
A. 该非天然油脂与氢氧化钠溶液共热,产物可与溴的四氯化碳溶液反应
B. 天然油脂、蔗糖、非天然油脂都能发生水解反应
C. 蔗糖、葡萄糖分别与银氨溶液水浴加热反应,有相同的实验现象
D. 植物油、非天然油脂都可以与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和![]() 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
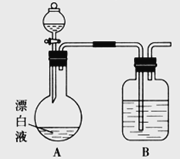
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和![]() 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加![]() 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是
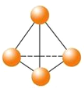
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882kJ热量
C.N4(g)=2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com