
【题目】在直流电的作用下,锌板上镀铜时,金属铜作( )
A.阳极 B.阴极 C.正极 D.负极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率(已知SO3,熔点16.8℃,沸点44.8℃)。

(1)这些装置的连接顺序(按气体从左到右的方向)是: → → → → → → → (填各接口的编号)。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是_________________________________________。
(3)写出Ⅱ中发生反应的化学方程式 。
(4)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_______(填“增大”、“不变”或“减小”)。Ⅳ处观察到的现象是_______________________________。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是
A.海水含镁,将金属钠放入海水中可以制取金属镁
B.从海水中提取溴的过程涉及氧化还原反应
C.利用海水制取精盐不涉及化学反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述中正确的是( )
A.石油的分馏和煤的气化都是发生了化学变化
B.苯、溴水、铁粉混合可制成溴苯
C.纤维素、油脂和蛋白质在一定条件下都能水解
D.苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2不能全部转化达为SO3
2SO3反应中,SO2不能全部转化达为SO3
D. 实验室用碳酸钙和盐酸反应制取CO2,若将块状碳酸钙粉碎,会加快反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱迪生电池在充电和放电时发生反应:Fe+ NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+
④充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.③⑤ B.③④ C. ①③ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:
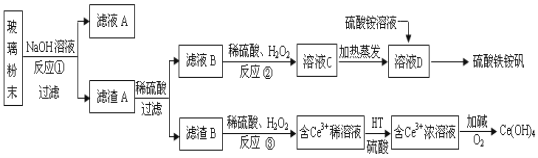
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属晶体的叙述正确的是( )
A.用铂金做首饰不能用金属键理论解释
B.固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体
C.金属晶体最密堆积方式只有面心立方堆积方式
D.金属导电和熔融电解质(或电解质溶液)导电的原理一样。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com