
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
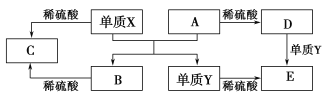
则下列说法正确( )
A.单质X与A反应的化学方程式:Al2O3+2Fe![]() Fe2O3+2Al
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-===Fe(SCN)3↓
C.单质X和单质Y在一定条件下均能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性化合物
科目:高中化学 来源: 题型:
【题目】分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有 (不含立体异构)
A.3 种 B.4 种 C.5 种 D.6 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把100 mL 0.3 mol·L-1 的硫酸溶液和50 mL 0.6 mol·L-1的硫酸溶液充分混合后,该溶液中H+的物质的量浓度为( )
A.0.6 mol·L-1 B.0.8 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 汽油、煤油、植物油均属于烃
B. 有机物完全燃烧的产物只有CO2和H2O
C. 乙醇、乙酸、乙酸乙酯均能与饱和Na2CO3溶液反应
D. C3H7Cl有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料﹣纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
(苯乙腈)
![]() +Cu(OH)2→(
+Cu(OH)2→(![]() )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如图(加热和夹持装置等略):
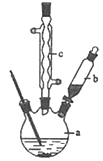
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 .
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 .反应结束后加适量冷水,再分离出苯乙酸粗品.加入冷水的目的是 ,下列仪器中可用于分离苯乙酸粗品的是 (填标号)
A、分液漏斗
B、漏斗
C、烧杯
D、直形冷凝管
E、玻璃棒
(3)提纯苯乙酸的方法是重结晶,最终得到44g纯品,则苯乙酸的产率是 .(百分数)
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:2NO(g) ![]() N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)
N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)/ c(NO)
B.常温下,NO、H2O、CO2三种化合物分解放出O2的进行程度由大到小的顺序为NO>H2O>CO2
C.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行的关于铁的性质的下列实验:
步骤 

现象依次为ⅠFe表面产生大量无色气泡,液面上方变为红棕色
ⅡFe表面产生少量红棕色气泡后,迅速停止
ⅢFe、Cu接触后,其表面均产生红棕色气泡
下列说法中不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com