
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
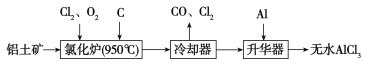
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是
______________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为
_______________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是___________________________。
【答案】
(1)加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动
(2)SO+Cl2+H2O===SO+2Cl-+2H+
(3)除去FeCl3
【解析】
试题分析:(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉中Al2O3转化为A1C13。为了促进该反应的顺利进行,试剂生产中加入焦炭消耗反应生成的氧,即反应方程式为:A12O3+3C12+3C![]() 2A1C13+3CO。
2A1C13+3CO。
故答案为:加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-。反应离子方程式为:SO32-+C12+H2O═SO42-+2C1-+2H+。
故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去。所以加入少量Al目的是除去FeCl3。
故答案为:除去FeCl3。


科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W、R是短周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 原子核内无中子 |
Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Z | 地壳中含量最高的元素 |
W | 原子质量数为23,中子数为12 |
R | 其离子是第三周期金属元素的离子中半径最小的 |
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是_____________(用元素符号表示)。
(2)Y2电子式为 ;X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是 (填共价或离子);X与Z形成的18e-微粒的结构式为 。
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为________,其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是__________________(用化学式表示)。
(4)W在元素周期表中的位置为_______;能够说明W和R金属性强弱的依据有 。
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是
A.海水含镁,将金属钠放入海水中可以制取金属镁
B.从海水中提取溴的过程涉及氧化还原反应
C.利用海水制取精盐不涉及化学反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 汽油、煤油、植物油均属于烃
B. 有机物完全燃烧的产物只有CO2和H2O
C. 乙醇、乙酸、乙酸乙酯均能与饱和Na2CO3溶液反应
D. C3H7Cl有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述中正确的是( )
A.石油的分馏和煤的气化都是发生了化学变化
B.苯、溴水、铁粉混合可制成溴苯
C.纤维素、油脂和蛋白质在一定条件下都能水解
D.苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱迪生电池在充电和放电时发生反应:Fe+ NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+
④充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.③⑤ B.③④ C. ①③ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴的工业流程如图:
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是 。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数及相应物质:
口Br2 + 口CO32-![]() 口BrO3-+ 口Br-+ 口
口BrO3-+ 口Br-+ 口
(4)上述流程中吹出的溴蒸气, 也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏,写出溴与二氧化硫水溶液反应的化学方程式: 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com