
【题目】将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是
A.FeB.Fe2O3C.FeCl3D.Fe(OH)3
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】下列过程中,发生吸热反应的是
A. 干冰气化B. 生石灰溶于水
C. 盐酸和氢氧化钠溶液混合D. Ba(OH)2·8H2O 与NH4Cl混合搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列有关叙述不正确的是( )
A.标准状况下,1 L庚烷所含有的分子数为 ![]()
B.1 mol甲基(﹣CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA
D.26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某化学实验小组通过实验探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下: Cu2O溶于稀硫酸生成Cu和CuSO4 , Cu2O在空气中加热生成Cu O
假设1:红色粉末是Cu2O
假设2:红色粉末是 Fe2O3
假设3:红色粉末是 Fe2O3、Cu2O的混合物取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂
(1)若假设2成立,则实验现象是 .
(2)若滴加KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含Fe2O3 . 你认为这种说法合理吗?;简述你的理由(不需要写方程式)
(3)若固体粉末完全溶解无固体存在,滴加 KSCN试剂后溶液不变红色,则证明原固体粉末是 , 写出发生反应的离子方程式、 . 经实验分析,确定红色粉末是Fe2O3 和 Cu2O 的混合物
(4)实验小组欲用加热法测定 Cu2O 的质量分数.取 mg 固体粉末在空气中充分加热,待质量不再变化时,称其质量为n g(n>m),则混合物中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下: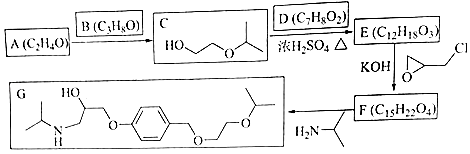
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6:1:1.
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应.
回答下列问题:
(1)A的结构简式为 .
(2)B的化学名称为 .
(3)C与D反应生成E的化学方程式为 .
(4)由E生成F的反应类型为 .
(5)G是分子式为 .
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有种;其中核磁共振氢谱为四组峰,峰面积比为3:2:2:1的结构简式为、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A是制取溴苯的实验装置,B、C是改进后的装置.请仔细分析,对比三个装置,回答以下问题: 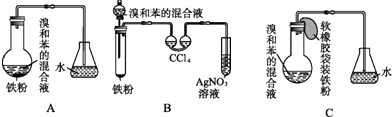
(1)写出三个装置中所共同发生的两个反应的化学方程式:、;写出B盛AgNO3溶液的试管中所发生反应的化学方程式: .
(2)装置A和C均采用了长玻璃导管,其作用是 .
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是; 应对装置C进行的操作是 .
(4)B中采用了双球洗气管吸收装置,其作用是 , 反应后双球洗气管中可能出现的现象是 .
(5)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行.这两个缺点是; .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响.实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示.下列说法正确的是( )
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A. 化学键的断裂和形成是化学反应能量变化的主要原因
B. 化学键存在所有单质和化合物中
C. 含有共价键的化合物不一定是共价化合物
D. N2分子中含有的共价键很强,故N2分子比较稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com