
【题目】下列叙述中不正确的是( )
A. 化学键的断裂和形成是化学反应能量变化的主要原因
B. 化学键存在所有单质和化合物中
C. 含有共价键的化合物不一定是共价化合物
D. N2分子中含有的共价键很强,故N2分子比较稳定
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是
A.FeB.Fe2O3C.FeCl3D.Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
(1)“碱溶”时生成偏铝酸钠的离子方程式为 .
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).
(3)“电解Ⅰ”是电解熔融 Al2O3 , 电解过程中作阳极的石墨易消耗,原因是 .
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 , 阴极产生的物质A的化学式为 .
(5)铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B . [实验化学]
1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36gcm﹣3 . 实验室制备少量1﹣溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr.
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止.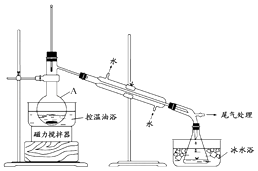
步骤3:将馏出液转入分液漏斗,分出有机相.
步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷.
(1)仪器A的名称是;加入搅拌磁子的目的是搅拌和 .
(2)反应时生成的主要有机副产物有2﹣溴丙烷和 .
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是 .
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是 .
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振荡, , 静置,分液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、离子键是构成物质微粒间的不同作用力,下列给出的物质中,含有上述两种作用力的是( )
A. NaOHB. Na2OC. H2SO4D. MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 . 
(2)“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .
(3)TiO2xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2xH2O转化率最高的原因 .
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .
(5)若“滤液②”中c(Mg2+)=0.02molL﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体.实验室由芳香化合物A制备H的一种合成路线如下: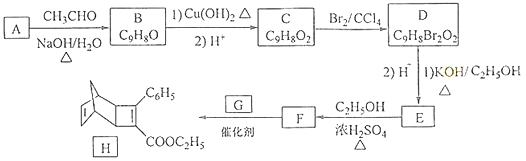
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
② ![]() +
+ ![]()
![]()
![]()
回答下列问题:
(1)A的化学名称为为 .
(2)由C生成D和E生成F的反应类型分别为、 .
(3)E的结构简式为 .
(4)G为甲苯的同分异构体,由F生成H的化学方程式为 .
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2 , 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式 .
(6)写出用环戊烷和2﹣丁炔为原料制备化合物 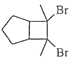 的合成路线(其他试剂任选).
的合成路线(其他试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl﹣ . 已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10﹣9 , Ka(HNO3)=4.2×10﹣10 . 下列说法正确的是( )
A.冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42﹣+2CH3COOH2+
B.H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4﹣)+2c(SO42﹣)+c(CH3COO﹣)
C.浓度均为0.1mol?L﹣1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸, ![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 只要是液体混合物就可用蒸馏来分离
B. 蒸馏时,应使温度计水银球置于蒸馏烧瓶支管口处
C. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 称量时,砝码放在托盘天平的右盘,先加质量大的砝码,后加质量小的砝码
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com