
����Ŀ����12�֣�����Ӧ�ù㷺�Ľ���������������Ҫ�ɷ�ΪAl2O3 �� ��SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ�����һ�ֹ����������£�
ע��SiO2�ڡ����ܡ�ʱת��Ϊ�������Ƴ�����
��1�������ܡ�ʱ����ƫ�����Ƶ����ӷ���ʽΪ ��
��2�����ˢ�������Һ�м���NaHCO3��Һ����Һ��pH ������������䡱��С������
��3���������ǵ������ Al2O3 �� ����������������ʯī�����ģ�ԭ���� ��
��4���������ǵ��Na2CO3��Һ��ԭ����ͼ��ʾ��
�����ĵ缫��ӦʽΪ �� ��������������A�Ļ�ѧʽΪ ��
��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ���� ��
���𰸡�
��1��Al2O3+2OH���T2AlO2��+H2O
��2����С
��3��ʯī�缫�������ϲ�����O2����
��4��4CO32��+2H2O��4e���T4HCO3��+O2����H2
��5��NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ
����������:��1�������ܡ�ʱ����ƫ�����Ƶ����ӷ���ʽΪAl2O3+2OH���T2AlO2��+H2O�����Դ��ǣ�Al2O3+2OH���T2AlO2��+H2O����2�����ˢ�������Һ�м���NaHCO3��Һ����NaAlO2��Ӧ������������������̼���ƣ�����ΪOH����AlO2����CO32�� �� ��֪��Һ��pH��С�����Դ��ǣ���С����3���������ǵ������ Al2O3 �� ����������������ʯī�����ģ���ʯī�缫�������ϲ�����O2������
���Դ��ǣ�ʯī�缫�������ϲ�����O2��������4����ͼ��֪��������ӦΪ4CO32��+2H2O��4e���T4HCO3��+O2���������������ӵõ�������������������������������A�Ļ�ѧʽΪH2 ��
���Դ��ǣ�4CO32��+2H2O��4e���T4HCO3��+O2����H2�� ��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ����NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ�����Դ��ǣ�NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������£��������绯ѧ��ʴ���� (����)
A.�����ڳ�ʪ�Ŀ�����
B.��������ˮ��
C.ͭ���ڵ���ˮ��
D.������ڳ�ʪ�Ŀ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A����ȡ�屽��ʵ��װ�ã�B��C�ǸĽ����װ�ã�����ϸ�������Ա�����װ�ã��ش��������⣺ 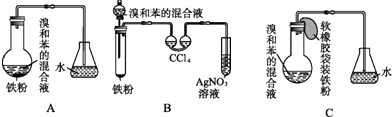
��1��д������װ��������ͬ������������Ӧ�Ļ�ѧ����ʽ������д��BʢAgNO3��Һ���Թ�����������Ӧ�Ļ�ѧ����ʽ�� ��
��2��װ��A��C�������˳��������ܣ��������� ��
��3���ڰ�װ��B��Cװ��������ҩƷ��Ҫʹ��Ӧ��ʼ��Ӧ��װ��B���еIJ������� Ӧ��װ��C���еIJ����� ��
��4��B�в�����˫��ϴ��������װ�ã��������� �� ��Ӧ��˫��ϴ�����п��ܳ��ֵ������� ��
��5��Bװ�ô����������Ե�ȱ�㣬ʹʵ���Ч�����û����������У�������ȱ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ֽ������ܶ�������Ӱ�죮ʵ���� 70��ʱ��ͬ������H2O2Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
A.ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B.ͼ�ұ���������������ͬʱ����ҺpHԽС��H2O2�ֽ�����Խ��
C.ͼ������������Mn2+����ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D.ͼ����ͼ��������������Һ�У�Mn2+��H2O2�ֽ����ʵ�Ӱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����(����)
A. ����������������
B. ����������������Ӧ
C. ������������Ӧ��������������
D. ������ԭ��Ӧ���κ�һ�ַ�Ӧ�ﲻ���������ͱض��ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣�������H��һ�����ںϳɦé����ڵ��ڼ���ҩ���м��壬��ϳ�·������ͼ����: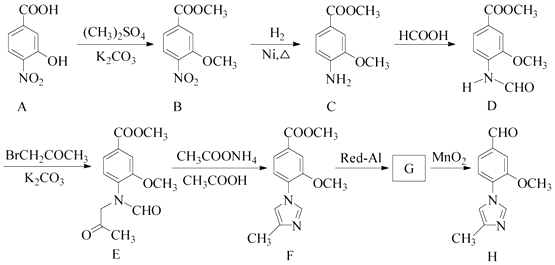
��1��C�еĺ�������������Ϊ�� ��
��2��D��E �ķ�Ӧ����Ϊ ��
��3��д��ͬʱ��������������C��һ��ͬ���칹��Ľṹ��ʽ�� ��
�ٺ��б������ҷ�������һ������̼ԭ�ӣ����ܷ���ˮ�ⷴӦ��ˮ�����֮һ�Ǧ��������ᣬ��һˮ����������ֻ��2�ֲ�ͬ��ѧ�������⣮
��4��G �ķ���ʽΪC12H14N2O2 �� �������õ�H��д��G�Ľṹ��ʽ�� ��
��5����֪�� 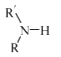
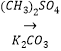
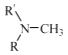 ��R����������R'����������H�� �����
��R����������R'����������H�� ��д���� 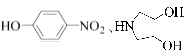 �ͣ�CH3��2SO4Ϊԭ���Ʊ�
�ͣ�CH3��2SO4Ϊԭ���Ʊ� ![]() �ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м������壬�ڶƲ㱻�ƻ�������ʴ����(����)
A.�����
B.��ͭ����
C.��������
D.��Ǧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ���ǣ� ��
A. ��ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�����仯����Ҫԭ��
B. ��ѧ���������е��ʺͻ�������
C. ���й��ۼ��Ļ����ﲻһ���ǹ��ۻ�����
D. N2�����к��еĹ��ۼ���ǿ����N2���ӱȽ��ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��̼���⡢������Ԫ����ɣ���ȡ3g A��4.48L����״�����������ܱ������г��ȼ�գ����ɶ�����̼��һ����̼��ˮ���������跴Ӧ��û��ʣ�ࣩ������Ӧ���ɵ���������ͨ��Ũ����ͼ�ʯ�ҳ�����գ�Ũ��������3.6g����ʯ������4.4g��ʣ���������Ϊ1.12L����״�������ش��������⣺
��1��3g Aȼ�պ�����������ʵ����ֱ�Ϊ��n��H2O��= �� n��CO2��= �� n��CO��= ��
��2��ͨ������ȷ��A�ķ���ʽ��
��3��д��A��һ�ֿ��ܵĽṹ��ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com