
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
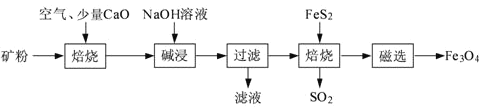
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2![]() ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
【答案】增大接触面积,加快反应速率 4 11 2 8 Al2O3+2NaOH=2NaAlO2+H2O OH-+CO2=HCO3-、AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 1:16
【解析】
高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)粉碎后通入空气、加入氧化钙焙烧,其中氧化钙和二氧化硫反应生成亚硫酸钙,和二氧化硅反应生成硅酸钙,得到产物加入氢氧化钠溶液碱浸,其中氧化铝溶解生成偏铝酸钠溶液,经操作I得到的固体中含Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,以此解答该题。
(1)粉碎高硫铝土矿的目的是增加接触面积,加快反应速率,提高浸出率;答案为增加接触面积,加快反应速率;
(2)反应中Fe元素化合价从+2价升高到+3价,S元素化合价从-1价升高到+4价,氧元素化合价从0价降低到-2价,根据电子得失和原子守恒可知配平后的反应方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
(3)Al2O3为两性氧化物,SiO2为酸性氧化物,Fe2O3为碱性氧化物,焙烧时,除发生FeS2的反应,还发生CaO与SiO2的反应,生成CaSiO3,即碱浸时发生的反应方程式为Al2O3+2NaOH=2NaAlO2+H2O;
(4)过滤后,滤液中有NaAlO2和NaOH,通入过量的CO2发生的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓、OH-+CO2=HCO3-;
(5)Fe2O3与FeS2发生的反应方程式为FeS2+16Fe2O3![]() 11Fe3O4+2SO2↑,理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。
11Fe3O4+2SO2↑,理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是( )
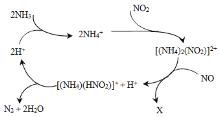
A.X是N2
B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的
C.NH4+中含有非极性共价键
D.上述历程的总反应为:2NH3+NO +NO2 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A. 2H2 (g)+O2 (g) == 2H2O(g);H =-Q1 2H2 (g)+O2 (g) == 2H2O(l);H = -Q2
B. S(g)+O2 (g) ![]() SO2 (g);H = -Q1 S(s)+O2 (g)
SO2 (g);H = -Q1 S(s)+O2 (g) ![]() SO2 (g);H = -Q2
SO2 (g);H = -Q2
C. C(s)+O2 (g) == CO2 (g);H = -Q1 C(s)+1/2O2 (g) == CO(g);H = -Q2
D. H2(g)+Cl2(g) == 2HCl(g);H =-Q1 1/2H2(g)+1/2Cl2(g) == HCl(g);H =-Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol CO2中含有________mol O原子,含有____________个CO2分子,质量为_________g ;
CO2的摩尔质量是_______________,在标准状况下的密度是______________,同温同压条件下该气体与氢气的密度之比是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,工业上电解熔融的甲可制取金属A。请回答:
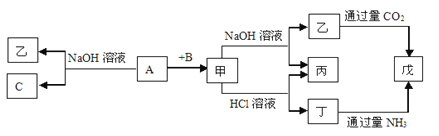
(1)写出下列物质的化学式:A__________、甲__________。
(2)写出乙物质的溶液中通入过量CO2的现象:________________________________;
(3)写出丁与过量氨水反应的离子方程式:__________________________________。
(4)写出A与NaOH溶液反应的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用勒夏特列原理解释的是
A. 加入催化剂有利于氨的合成
B. 煅烧粉碎的黄铁矿矿石有利于SO2的生成
C. 硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com