
【题目】2mol CO2中含有________mol O原子,含有____________个CO2分子,质量为_________g ;
CO2的摩尔质量是_______________,在标准状况下的密度是______________,同温同压条件下该气体与氢气的密度之比是______________。
【答案】4 1.204×1024 88 44 g/mol 1.96g/L 22:1
【解析】
1个CO2分子中含有2个O原子,所以2mol CO2中含有4mol O原子,根据![]() ,2mol CO2中含有2×6.02×1023=1.204×1024个CO2分子,根据
,2mol CO2中含有2×6.02×1023=1.204×1024个CO2分子,根据![]() ,2mol CO2的质量为2mol×44g/mol= 88g;
,2mol CO2的质量为2mol×44g/mol= 88g;
摩尔质量用g/mol作单位时,摩尔质量的数值等于相对分子质量,所以CO2的摩尔质量是44 g/mol,1mol CO2的质量是1mol×44 g/mol= 44g, 1mol CO2在标准状况下的体积是1mol×22.4 L/mol =22.4L,在标准状况下的密度是![]() 1.96g/L,根据阿伏加德罗定律的推论,同温同压条件下,气体密度之比等于气体摩尔质量之比,所以该气体与氢气的密度之比是44:2=22:1。
1.96g/L,根据阿伏加德罗定律的推论,同温同压条件下,气体密度之比等于气体摩尔质量之比,所以该气体与氢气的密度之比是44:2=22:1。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

(1)J的化学式为__________________ ;F的名称为__________________。
(2)B中官能团名称为____________________ 。
(3)I—J的反应类型为____________________ 。
(4)F -G的反应方程式为____________________ 。
(5)与I属于同种类型物质且苯环上有两个取代基的同分异构体有____种。符合下列条件的J的一种同分异构体结构简式为______。
①属于芳香族化合物 ②不能与金属钠反应 ③有3种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4 , B管中是NaOH溶液,请回答下列问题。
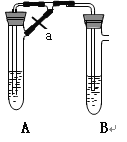
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Zn +2 HCl = ZnCl2 + H2↑的反应中,氧化剂是_________,失去电子的是_________,化合价降低的元素是_________,氧化产物是_________,还原产物是_________,画出该反应的双线桥并标出电子转移的方向和数目:__________________
Zn + 2 HCl = ZnCl2 + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
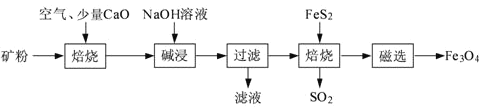
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2![]() ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
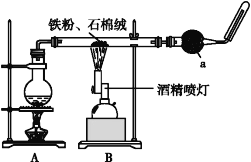
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
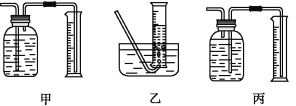
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为![]() ,电池结构如图所示。下列说法正确的是
,电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 充电时,应将铝石墨电极与电源负极相连
C. 放电时,正极反应式为Cx(PF6) +e = xC + PF6
D. 充电时,若电路中转移1mol电子,则阴极质量增加9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Na2S的水解:S2-+ 2H2O![]() H2S + 2OH
H2S + 2OH
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O![]() NH3·H2O + OH
NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com