
【题目】铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为![]() ,电池结构如图所示。下列说法正确的是
,电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 充电时,应将铝石墨电极与电源负极相连
C. 放电时,正极反应式为Cx(PF6) +e = xC + PF6
D. 充电时,若电路中转移1mol电子,则阴极质量增加9g
【答案】C
【解析】
A. 放电时,外电路中电子向正极移动;
B. 充电时,铝石墨电极的C元素化合价升高,发生氧化反应,为电解池的阳极;
C. 依据原电池的工作原理书写电极反应式;
D. 阴极锂离子发生还原反应,电极反应为:Al+Li++e-═AlLi;
A. 放电过程为原电池原理,外电路电子从负极流出,流向正极。根据反应总方程式可知,该装置放电过程中,锂元素化合价升高发生氧化反应,碳元素化合价降低发生还原反应,所以铝锂电极做负极,铝石墨电极做正极,则外电路电子向铝石墨电极移动,故A项错误;
B. 充电过程为放电过程的逆过程,铝石墨电极作为阳极与电源的正极相连,故B项错误;
C. 放电时正极发生还原反应,其电极反应式可表示为:Cx(PF6) +e = xC + PF6,故C项正确;
D. 充电时,阴极锂离子发生还原反应,电极反应为:Al+Li++e-═AlLi,所以转移1 mol e-,阴极电极从Al变为AlLi将增重1 mol×7g/mol = 7 g,故D项错误;
答案选C。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】25℃时,H2A(酸):K1=4.3×10-7,K2=2.1×10-12。H2B(酸):K1=1.0×10-7,K2=6.3×10-13,若有浓度相同的两种溶液(填“>”、“<”或“=”)。回答谢列问题:
(1)①H+的浓度:H2A________H2B;②溶液的导电能力:H2A________H2B;
(2)写出H2B酸溶液中所有的粒子__________;
(3)①写出H2A的电离方程式___________。②写出NaHA的电离方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列对晶体结构和性质的认识错误的是______
A.“雪花→水→水蒸气→氧气和氢气”变化中,被破坏的粒子间的作用力依次是:氢键、氢键、极性键
B.晶体CO2和H2O中,微利间相互作用完全相同,晶体类型也相同
C.SiO2晶体最小的环上,有6个Si原子和6个O原子
D.金刚石和石墨的熔点都较高,是因为二者都为原子晶体
II.黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)Fe在周期表中的位置为______________________;Fe、S、O原子的第一电离能由大到小的顺序是_________________________。
(2)CuFeS2中Cu元素有________个未成对电子,Cu2S中Cu元素基态时电子排布式为__________。
(3)SO2分子的立体构型为_____________,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是__________________。

(4)已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因_________。

(5)Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有_____个,晶胞的边长为___________(用含ρ和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“常见无机物”,主要是指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
(1)四种元素原子的半径大小 Fe> > > 。_________
(2)铝原子最外层电子排布式为_____,核外共有_____种不同运动状态的电子。
(3)实验室制备氯化氢气体的反应:_____。其制备装置和实验室制备_气体类似(填化学式)。
(4)16g 硫磺在过量氧气中燃烧放出 149kJ 的热量,写出该热化学方程式______________。
(5)比较两种化合物熔点高低,氯化钠_____氧化镁,请解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是
A. 1.0molCH4与3.0molCl2光照下反应生成的CHCl3分子数为1.0NA
B. 1.0mol·L-1的(NH4)3PO4溶液中阳离子数为3.0NA
C. 5.6gFe与过量浓盐酸完全反应转移的电子数为0.2NA
D. 常温下2.24LSO3中含有的质子数为4.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以香兰醛(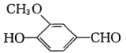 )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下:
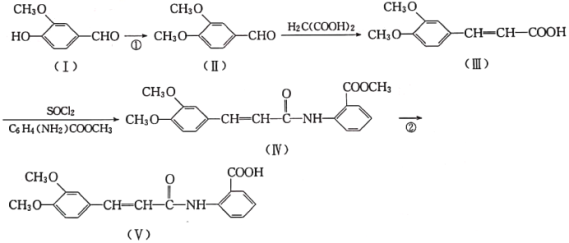
已知:![]() (酰胺键)在无肽键酶作用下的水解可忽略。
(酰胺键)在无肽键酶作用下的水解可忽略。
(1)H2C(COOH)2的化学名称为___________。
(2)①的反应类型是___________。
(3)反应②所需试剂条件分别为___________、___________。
(4)利喘贝(V)的分子式为___________。
(5)Ⅲ中官能团的名称是______________________。
(6)写出与香兰醛互为同分异构体的酯类化合物的结构简式(且核磁共振氢谱为四组峰,峰面积之比为1:2:2:3):____________________________________________(写出3种)。
(7)已知:![]() ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(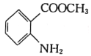 )的合成路线(其他无机试剂任选):__________________________________________________________________。
)的合成路线(其他无机试剂任选):__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是

A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com