
【题目】25℃时,H2A(酸):K1=4.3×10-7,K2=2.1×10-12。H2B(酸):K1=1.0×10-7,K2=6.3×10-13,若有浓度相同的两种溶液(填“>”、“<”或“=”)。回答谢列问题:
(1)①H+的浓度:H2A________H2B;②溶液的导电能力:H2A________H2B;
(2)写出H2B酸溶液中所有的粒子__________;
(3)①写出H2A的电离方程式___________。②写出NaHA的电离方程式__________。
【答案】 > > H2O、H2B、HB-、H+、B2-、OH- H2A ![]() HA- + H+ HA-
HA- + H+ HA- ![]() A2- + H+ NaHA = Na+ + HA- HA-
A2- + H+ NaHA = Na+ + HA- HA- ![]() A2- + H+
A2- + H+
【解析】
(1)相同温度、相同浓度下,电离常数越大电离度越大,相同温度、相同浓度下,电离平衡常数越大其电离程度越大。多元弱酸分步电离,其第一步电离远远大于其第二步电离,由于H2A的K1大于H2B的K1 ,所以H+的浓度:H2A![]() H2B;离子浓度越大导电能力越强,所以溶液的导电能力:H2A>H2B;(2)依据H2B
H2B;离子浓度越大导电能力越强,所以溶液的导电能力:H2A>H2B;(2)依据H2B![]() HB-+ H+ 、HB-
HB-+ H+ 、HB-![]() B2-+ H+ 、H2O
B2-+ H+ 、H2O![]() H++ OH-可知H2B酸溶液中的粒子有:H2O、H2B、HB-、H+、B2-、OH-;(3) H2A是二元弱酸,分两步电离,①H2A的电离方程式H2A
H++ OH-可知H2B酸溶液中的粒子有:H2O、H2B、HB-、H+、B2-、OH-;(3) H2A是二元弱酸,分两步电离,①H2A的电离方程式H2A ![]() HA- + H+ 、HA-
HA- + H+ 、HA- ![]() A2- + H+ 。②NaHA的电离方程式NaHA = Na+ + HA- 、 HA-
A2- + H+ 。②NaHA的电离方程式NaHA = Na+ + HA- 、 HA- ![]() A2- + H+。
A2- + H+。


科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型非金属材料,室温下能缓慢水解。可由铝粉在氮气氛围中1700℃合成,产物为白色到灰蓝色粉末。某小组探究在实验室制备AlN并测定产品纯度,设计实验如下。请回答:
(一)制备AlN

(1)按气流由左向右的方向,上述装置的正确连接顺序为j→__________________→i(填仪器接口字母编号)。
(2)实验时,以空气为原料制备AlN。装置A中还原铁粉的作用为________________,装置B中试剂X为_____________________。
(二)测定产品纯度
取m g的产品,用以下装置测定产品中AlN的纯度(夹持装置已略去)。
已知:AlN + NaOH + H2O = NaAlO2 + NH3↑
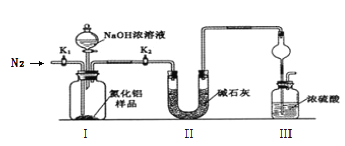
(3)完成以下实验步骤:组装好实验装置,首先_________________________________,加入实验药品。接下来的实验操作是关闭______________________________并打开______________,再打开分液漏斗活塞加入足量NaOH浓溶液后关闭,至不再产生气体。再______________,通入氮气一段时间,测定装置III反应前后的质量变化为n g。
(4)实验结束后,计算产品中AlN的纯度为___________﹪(用含m、n的代数式表示)。
(5)上述实验的设计仍然存在缺陷,你认为可能的缺陷及会导致的测定结果____________(用 “偏高”、“偏低”描述)如何______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数H2SO3:H2SO3HSO3- + H+ K1=1.54×10-2 ,HSO3SO32- + H+ K2=1.02×10-7; H2CO3:H2CO3HCO3- + H+ K1=4.4×10-7HCO3-CO32- + H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是
A. HSO3-、CO32- B. HSO3-、HCO3-
C. SO32-、HCO3- D. SO32-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质互为同系物的是
A. 35Cl和37ClB. O2和O3C. C2H6和C5H12D. CH3CH2CH2CH3和CH3CH(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是

A.溶液酸性越强,R 的降解速率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为![]() ,电池结构如图所示。下列说法正确的是
,电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 充电时,应将铝石墨电极与电源负极相连
C. 放电时,正极反应式为Cx(PF6) +e = xC + PF6
D. 充电时,若电路中转移1mol电子,则阴极质量增加9g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com