
【题目】一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是

A.溶液酸性越强,R 的降解速率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有1mL 0.01 mol/L | 证明在相同温度下的 Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为短周期表的一部分,其中E为地壳中含量最高的元素。

请完成下列问题:
(1)D元素在元素周期表中的位置______________。
(2)A、E简单离子的半径由大到小顺序为___________(用具体的微粒符号表示,下同)。
(3)写出A和F两种元素的最高价氧化物的水化物相互反应的离子方程式_________。
(4)写出将过量C的最高价氧化物通入含B的盐溶液中的离子方程式____________。
(5)证明元素F和G的非金属性强弱(用化学方程式表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物。实验室由芳香化合物A制备G的合成路线如下:
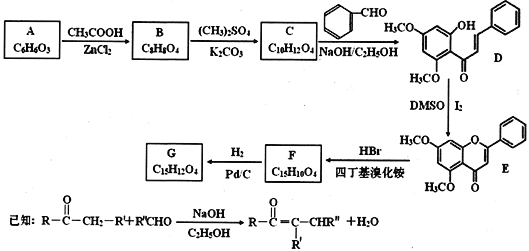
回答以下问题:
(1)A中的官能团名称为________________。E的分子式为________________。
(2)由A生成B和由F生成G的反应类型分别是________________、____________。
(3)由C生成D的化学方程式为____________________。
(4)G的结构简式为____________________。
(5)芳香化合物X是B的同分异构体,可与FeCl3溶液发生显色反应,1molX可与4 mol NaOH反应,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3:2:2:1。写出一种符合要求的X的结构简式____________。
(6)写出用环戊烯和正丁醛为原料制备化合物![]() 的合成路线(其他试剂任选):__
的合成路线(其他试剂任选):__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。

①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:

NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C. 图丙表示催化剂能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础
有机物Ⅰ广泛应用在航空、激光等领城,Ⅰ的一种合成路线如下:
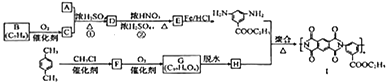
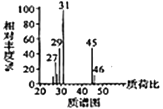
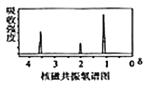
已知:①有机物A的质谱图与核磁共振氢谱图如下:
①2RCOOH![]()
![]() +H2O
+H2O
②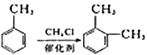
回答下列问题:
(1)A的化学名称是________,C中含氧官能团的名称是________。
(2)②的反应类型为_________,Ⅰ的分子式为_________。
(3)①的反应方程式为_______________________________________。
(4)F的结构简式是______________。
(5)同时满足下列条件的G的同分异构体共有________种(不含立体结构),写出其中的一种结构式:__________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)写出用间二甲苯和甲醇为原料制备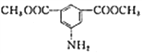 的合成路线:________________(其他试剂任选)。
的合成路线:________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
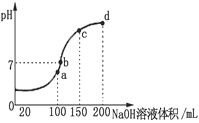
(4)浓度均为0.1 mol·L-1 NH4Al(SO4)2溶液和NH4HSO4溶液,其中______溶液c(NH4+)大。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com