
����Ŀ����ͼΪ�����ڱ���һ����,����EΪ�ؿ��к�����ߵ�Ԫ�ء�

�������������:
��1��DԪ����Ԫ�����ڱ��е�λ��______________��
��2��A��E�����ӵİ뾶�ɴ�С˳��Ϊ___________(�þ���������ű�ʾ,��ͬ)��
��3��д��A��F����Ԫ�ص�����������ˮ�������Ӧ�����ӷ���ʽ_________��
��4��д��������C�����������ͨ�뺬B������Һ�е����ӷ���ʽ____________��
��5��֤��Ԫ��F��G�ķǽ�����ǿ��(�û�ѧ����ʽ��ʾ)___________________��
���𰸡���2����VA�� O2-��Na+ OH��+H+��H2O 2CO2+SiO32-+2H2O��H2SiO3��+2HCO3- H2S+C12��S+2HCl(�����𰸺���Ҳ����)
��������
�ɶ����ڱ���һ���ֿ�֪Eλ�ڵڶ����ڣ�����EΪ�ؿ��к�����ߵ�Ԫ�أ�EΪO��������λ�ÿ�֪CΪC��DΪN��AΪNa��BΪSi��FΪS��GΪCl���ݴ˽��
������������֪��AΪNa��BΪSi��CΪC��DΪN��EΪO��FΪS��GΪCl����
��l��DԪ���ǵ�����Ԫ�����ڱ��е�λ��Ϊ�ڶ�����VA�壻
��2��A��E�����Ӿ�����ͬ�ĺ�������Ų����˵����Խ�����Ӱ뾶ԽС��������ӵİ뾶�ɴ�С˳��ΪO2-��Na+��
��3��A��F����Ԫ�ص�����������ˮ����ֱ����������ƺ����ᣬ���Ӧ�����ӷ���ʽΪOH��+H+��H2O��
��4��̼�������ǿ�ڹ��ᣬ����C����������������̼ͨ�뺬B������Һ�е����ӷ���ʽΪ2CO2+SiO32-+2H2O��H2SiO3��+2HCO3-��
��5���������û���������֤��Ԫ��F��G�ķǽ�����ǿ�����û�ѧ����ʽ�ɱ�ʾΪH2S+C12��S+2HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��,101kPa��,1gC8H28(����)ȼ�����ɶ�����̼��Һ̬ˮʱ�ų�48.4kJ����.��ʾ������Ӧ���Ȼ�ѧ����ʽ��ȷ����
A. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ��H=-5517.6 KJ��mol��1
O2(g)===8CO2(g)+9H2O(l) ��H=-5517.6 KJ��mol��1
B. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ��H=-48.4 KJ��mol��1
O2(g)===8CO2(g)+9H2O(l) ��H=-48.4 KJ��mol��1
C. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ��H=+5517.6 KJ��mol��1
O2(g)===8CO2(g)+9H2O(l) ��H=+5517.6 KJ��mol��1
D. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ��H=+48.4 KJ��mol��1
O2(g)===8CO2(g)+9H2O(l) ��H=+48.4 KJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ƕ����ѽ��ʵ�����̣�����ʾ��������һ���������ѽ�Ŀ��ܷ���ʽΪ��C4H10![]() C2H6+C2H4�� C4H10
C2H6+C2H4�� C4H10![]() CH4+C3H6��
CH4+C3H6��
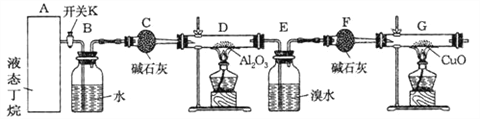
���Ӻ�װ�ú�����е�ʵ������У�
�ٸ�D��Gװ�ü��ȣ��ڼ������װ�õ������ԣ����ų�װ���еĿ�������
��1���������������Ⱥ�˳��������_______________________������ţ�
��2��д������������ͭ��Ӧ�Ļ�ѧ����ʽ______________________
��3������Eװ���еĻ�����ˮ���������ٰ���������ʵ�飺
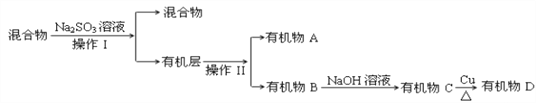
�ٷ�����������������Ʒֱ��ǣ���________��________��Na2SO3��Һ�������ǣ������ӷ���ʽ��ʾ��________________________________________________________��
����֪B��̼ԭ��������A��̼ԭ��������д��B�Ľṹ��ʽ_____________________��
��4���ٶ�������ȫ�ѽ�������E+F��װ�õ��������ȷ�Ӧǰ������0��7 g�� Gװ�õ�����������1��76 g��������ѽ�����м������������ʵ���֮�� n��CH4��: n��C2H6��=__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��Cu2O�����ͭ��Cu2S����ϼ��ȷ������·�Ӧ��2Cu2O+Cu2S![]() 6Cu+SO2��������˵���������
6Cu+SO2��������˵���������
A. ��Cu2O��Cu2S��CuԪ�ػ��ϼ۶���+1�� B. ��Ӧ��CuԪ�ر�������SԪ�ر���ԭ
C. Cu2S�ڷ�Ӧ�м��������������ǻ�ԭ�� D. ÿ����6.4gCu����Ӧ��ת��0.1mol e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮϵ�����ӵ�ع���ԭ������ͼ��ʾ��TiO2��缫��ʹ�����̫�������³�磬���ʱNa2S4��ԭΪNa2S������˵���������
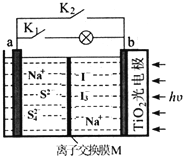
A. ���ʱ��̫����ת��Ϊ���ܣ���ת��Ϊ��ѧ��
B. �ŵ�ʱ��a���ĵ缫��ӦʽΪ��4S2--6e-=S42-
C. ���ʱ�������ĵ缫��ӦʽΪ��3I--2e-=I3-
D. M�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ף�PCl5�����л��ϳ�����Ҫ���Ȼ���������PCl5��s��![]() PCl3��g����Cl2��g����Ӧ���¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
PCl3��g����Cl2��g����Ӧ���¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 50 | 150 | 250 | 350 |
n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
����˵����ȷ����
A. ��ͬ�����£���ʼʱ�������г���2.0 mol PCl5��PCl5�ķֽ�������
B. ֻ�����¶ȣ�ƽ��ʱc��PCl5����0.12 mol/L��������Ӧ�Ƿ��ȷ�Ӧ
C. ��Ӧ��ǰ50 s��ƽ������v��PCl3����0.0032 mol/��L��s��
D. ���ܱյ��µ������£�������PCl5����ı���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù�ҵ�����·ۺ��Ǧп����(��Ҫ�ɷ�ΪZnO��PbSO4������Ϊ��Si��Fe(III)��Cu��Cd��Ԫ�صĻ�����)Ϊԭ�ϣ��ƻ�������п�ͻ�ɫ����Ǧ���ƣ���ҵ������ͼ��ʾ��
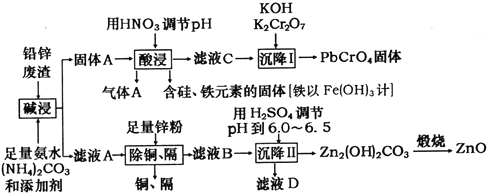
��֪������Ksp(PbSO4)=1.6��10-5��Ksp(PbCO3)=7.4��10-14��Ksp[Fe(OH)3]=1.0��10-38��
(1)�������������PbSO4������Ӧ�����ӷ���ʽΪ_______________________________������A�Ļ�ѧʽΪ_________________________��
(2)������������У��ڳ�����Ӧ����pH������________________________________��
(3)������I���з���������Ӧ�����ӷ���ʽΪ____________________________��
(4)��ҺD�����ʵ���Ҫ�ɷ�Ϊ________________��
(5)��1t��пԪ��10����Ǧп�����Ƶû�������п113.4kg���������������ܷ�����пԪ�صĻ����ʡ����ܣ�д���������������ܣ���˵�����ɡ�___________________��
(6)������NH3��H2O�ĵ��볣��Kb=1.8��10-5��̼��ĵ��볣����Ka1=4.4��10-7��Ka2=5.6��10-11�����¶���ijŨ�ȵ�(NH4)2CO3��Һ��c(NH4+)��c(NH3��H2O)=18������ҺpHΪ__________________��c(HCO3-)��c(H2CO3)=____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������Һ������Զ�TiO2���ȼ��R���ⷴӦ��Ӱ����ͼ��ʾ�������ж���ȷ����

A����Һ����Խǿ��R �Ľ�������ԽС
B��R����ʼŨ��ԽС����������Խ��[
C����0��50 min֮�䣬pH=2��PH=7ʱR�Ľ���ٷ������
D����20��25 min֮�䣬pH=10 ʱR��ƽ����������Ϊ0.04 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 0.1 mol��L-1 ������Һ��25 ���µ�ϡ���̣�����ȷ����
A. ����ĵ���ƽ�ⳣ������ B. ��Һ��c(H+)��С
C. c(H��)/c(CH3COOH)���� D. ������Һ���������ӵ�Ũ�Ⱦ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com