
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
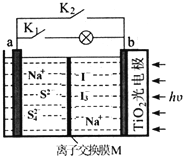
A. 充电时,太阳能转化为电能,又转化为化学能
B. 放电时,a极的电极反应式为:4S2--6e-=S42-
C. 充电时,阳极的电极反应式为:3I--2e-=I3-
D. M是阴离子交换膜
【答案】D
【解析】TiO2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又能转化为化学能,充电时Na2S4还原为Na2S,放电和充电互为逆过程,所以a是负极,b是正极,在充电时,阳极失电子发生氧化反应,3I--2e-=I3-,据此回答。
TiO2光电极能使电池在太阳光照下充电,所以充电时,太阳能转化为电能,电能又能转化为化学能,A正确;充电时Na2S4还原为Na2S,放电和充电互为逆过程,所以a是负极,a极的电极反应式为:4S2--6e-=S42-,B正确;在充电时,阳极I-失电子发生氧化反应,极反应为3I--2e-=I3-,C正确;通过图示可知,交换膜只允许钠离子自由通过,所以M是阳离子交换膜,D错误;正确选项D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
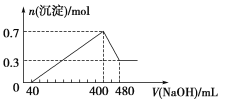
计算:
(1)合金中Mg的质量为________g;
(2)硫酸的物质的量浓度为________ mol·L1;
(3)NaOH溶液的物质的量浓度为________ mol·L1;
(4)生成H2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
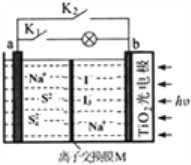
A. 关闭K2打开K1时,该装置实现太阳能转化为电能,又转化为化学能
B. M是阳离子交换膜.
C. 充电时,阳极的电极反应式为:3I--2e-=I3-
D. 放电时,b极区总离子浓度减小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH+Ca2++2OH-+SO![]() ===CaSO3↓+2NH3·H2O。
===CaSO3↓+2NH3·H2O。
(1)已知:25 ℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=__________(用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
ⅱ.2H2(g)+SO2(g) ![]() S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
(2)写出CO(g)与H2O(g)反应生成CO2(g) 、H2(g)的热化学方程式为_______________。
若该反应在绝热、恒容体系中进行,达到平衡的标志___________。
A.氢氧键的断裂速率等于氢氢键的断裂速率
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D. H2O(g) 与H2(g)的体积比保持不变
(3)反应ⅱ的正反应的活化能E________(填“>”“<”或“=”)ΔH2。
(4)在一定压强下,发生反应ⅱ。平衡时,α(SO2) (二氧化硫的转化率)与原料气投料比[![]() ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。

①α(H2):M________(填“>”“<”或“=”)N。
②逆反应速率:M________(填“>”“<”或“=”)Q。
(5)T ℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol SO2(g)和2 mol H2(g),发生反应ⅰ和反应ⅱ。5 min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应ⅱ的平衡常数K=________。
②其他条件不变,6 min时缩小容器容积。α(SO2)__________(填“增大”“减小”或“不变”),原因为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为短周期表的一部分,其中E为地壳中含量最高的元素。

请完成下列问题:
(1)D元素在元素周期表中的位置______________。
(2)A、E简单离子的半径由大到小顺序为___________(用具体的微粒符号表示,下同)。
(3)写出A和F两种元素的最高价氧化物的水化物相互反应的离子方程式_________。
(4)写出将过量C的最高价氧化物通入含B的盐溶液中的离子方程式____________。
(5)证明元素F和G的非金属性强弱(用化学方程式表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解;
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中;
操作3:继续向X中加蒸馏水至液面离X的刻度线l~2cm处;
操作4、操作5:见图
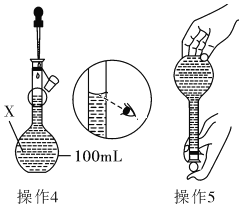
(1)仪器X的名称是______________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度__(选填“偏大”、“偏小”、“无影响”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。

①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:

NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B. 1 mol H2O最多可形成4NA个氢键
C. 常温下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,原子总数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com