
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解;
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中;
操作3:继续向X中加蒸馏水至液面离X的刻度线l~2cm处;
操作4、操作5:见图
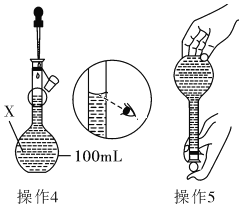
(1)仪器X的名称是______________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度__(选填“偏大”、“偏小”、“无影响”或“无法判断”)。
科目:高中化学 来源: 题型:
【题目】如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①②③三种不同的环境中

请回答:
(1)金属腐蚀主要分为__________腐蚀和_____________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是_________________(填序号)。
(3)①中正极的电极反应式为_________________________________________________,②中负极的电极反应式为_________________________________________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有__________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法正确的是
A. “冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”。 “薪柴之灰”与铵态氮肥混合施用可增强肥效。
B. 玻璃和压电陶瓷都属于新型无机非金属材料。
C. 侯德榜制碱法的原理是在饱和食盐水中先通二氧化碳后通氨气制得碳酸钠。
D. 高铁酸钾(K2FeO4)在水处理过程中涉及的变化过程有:蛋白质的变性、胶体吸附、盐类水解、氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
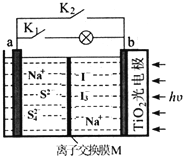
A. 充电时,太阳能转化为电能,又转化为化学能
B. 放电时,a极的电极反应式为:4S2--6e-=S42-
C. 充电时,阳极的电极反应式为:3I--2e-=I3-
D. M是阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是____________。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:_________,然后关闭活塞1,接下来的操作是:_________________。C中发生反应的离子方程式为_______________________________。
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应方程式为_______________________________________。为防止乳酸亚铁变质,在上述体系中还应加入______________________。反应结束后,将所得溶液隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥得乳酸亚铁晶体。该晶体存放时应注意_______。
III.乳酸亚铁晶体纯度的测量:
(4)两位同学分别用不同方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是________________________________。
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+还原为Ce3+),称取6.00g样品配制成250.00mL溶液,取25.00mL用0.10mol·L-1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为__________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质为含Si、Fe(III)、Cu、Cd等元素的化合物)为原料,制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
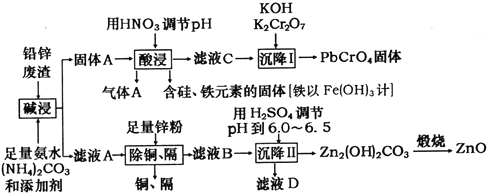
已知常温下Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=7.4×10-14,Ksp[Fe(OH)3]=1.0×10-38。
(1)“碱浸”过程中PbSO4发生反应的离子方程式为_______________________________,气体A的化学式为_________________________。
(2)“酸浸”过程中,在常温下应控制pH不低于________________________________。
(3)“沉降I”中发生沉降反应的离子方程式为____________________________。
(4)滤液D中溶质的主要成分为________________。
(5)以1t含锌元素10%的铅锌废渣制得活性氧化锌113.4kg,依据以上数据能否计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由。___________________。
(6)常温下NH3·H2O的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=5.6×10-11。该温度下某浓度的(NH4)2CO3溶液中c(NH4+)/c(NH3·H2O)=18。则溶液pH为__________________,c(HCO3-)/c(H2CO3)=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
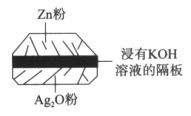
(1)该电池属于__________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是____________。
(3)使用时,负极区的pH_______(填“增大”、“减小”或“不变”,下同),电解质溶液的pH__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )

A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某恒温恒容密闭容器中充入0.2 mol X,发生如下反应:2X(g)![]() Y(g)+3Z(g) ΔH=a kJ·mol-1(a>0)。下列说法正确的是
Y(g)+3Z(g) ΔH=a kJ·mol-1(a>0)。下列说法正确的是
A. 增大X的浓度,正反应速率增大,逆反应速率减小
B. 当混合气体的密度不再变化时,该反应达到化学平衡状态
C. 达到化学平衡状态时,共吸收 0.1a kJ的热量
D. 若平衡后再向反应器中充入 0.2 mol X,达平衡后,X的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com