
����Ŀ���ù�ҵ�����·ۺ��Ǧп����(��Ҫ�ɷ�ΪZnO��PbSO4������Ϊ��Si��Fe(III)��Cu��Cd��Ԫ�صĻ�����)Ϊԭ�ϣ��ƻ�������п�ͻ�ɫ����Ǧ���ƣ���ҵ������ͼ��ʾ��
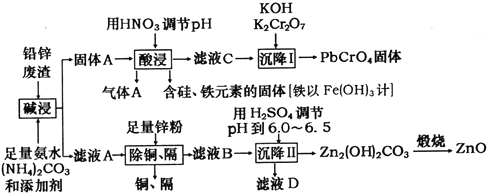
��֪������Ksp(PbSO4)=1.6��10-5��Ksp(PbCO3)=7.4��10-14��Ksp[Fe(OH)3]=1.0��10-38��
(1)�������������PbSO4������Ӧ�����ӷ���ʽΪ_______________________________������A�Ļ�ѧʽΪ_________________________��
(2)������������У��ڳ�����Ӧ����pH������________________________________��
(3)������I���з���������Ӧ�����ӷ���ʽΪ____________________________��
(4)��ҺD�����ʵ���Ҫ�ɷ�Ϊ________________��
(5)��1t��пԪ��10����Ǧп�����Ƶû�������п113.4kg���������������ܷ�����пԪ�صĻ����ʡ����ܣ�д���������������ܣ���˵�����ɡ�___________________��
(6)������NH3��H2O�ĵ��볣��Kb=1.8��10-5��̼��ĵ��볣����Ka1=4.4��10-7��Ka2=5.6��10-11�����¶���ijŨ�ȵ�(NH4)2CO3��Һ��c(NH4+)��c(NH3��H2O)=18������ҺpHΪ__________________��c(HCO3-)��c(H2CO3)=____________________��
���𰸡� PbSO4 (s) + CO32��(aq) =PbCO3(s) + SO42�� (aq) CO2 3 2Pb2++ 2OH��+Cr2O72��=2PbCrO4��+H2O (NH4)2SO4 ���ܣ���ȥͭ���ӵĹ�����������п�ۣ�����ZnO�е�пԪ�ز���ȫ������Ǧп������������Ǧп������пԪ�صĻ����� 8 44
��������Ǧп����(��Ҫ�ɷ�ΪZnO��PbSO4������Ϊ��Si��Fe(III)��Cu��Cd��Ԫ�صĻ�����)Ϊԭ�ϣ����백ˮ��̼��什��С���������õ�����Ậ��PbCO3�Լ�����Si��Fe(III)�Ļ�����������ᣬ�������������̼�����˵õ����������й�Ļ�������������ȣ���ҺC�к�������Ǧ���������������Լ��ظ���أ����Եõ�PbCrO4���壻��ҺA�к���Zn��Cu��Cd�Ļ��������������п�ۿɳ�ȥCu��Cd����ҺB��Ҫ����п�Ļ��������ϡ�������pH�ɵõ�Zn2(OH)2CO3�����ȷֽ�õ�����п���Դ˽����⡣
��1����֪��������Ksp(PbSO4)=1.6��10-5��Ksp(PbCO3)=7.4��10-14�����ԡ������������PbSO4������Ӧ�����ӷ���ʽΪPbSO4 (s) + CO32��(aq) =PbCO3(s) + SO42�� (aq)��������������������Ϊ������̼����ѧʽΪCO2����ȷ�𰸣�PbSO4 (s) + CO32��(aq) =PbCO3(s) + SO42�� (aq)�� CO2��
(2) ������������У���pH���ͣ�����ǿ�������ᷴӦ���ɵ��й����Ļ����������Һ�У��ټӼ�ʱ�������������������������c(Fe3+)=1��10-5mol/Lʱ��Ksp[Fe(OH)3]= c(Fe3+)��c3(OH-)=1.0��10-38��c(OH-)=10-11mol/L��c(H+)=10-3 mol/L��pH=3�����Ҫ���ȥ�����ӣ��ڳ�����Ӧ����pH������3����ȷ�𰸣�3��
(3)�������̿�֪��Pb2+�ڼ��Ի�������Cr2O72����Ӧ����PbCrO4�����ӷ���ʽΪ2Pb2++ 2OH��+Cr2O72��=2PbCrO4��+H2O����ȷ�𰸣�2Pb2++ 2OH��+Cr2O72��=2PbCrO4��+H2O��
(4) ��ͼ֪��ҺB�к��е�����ΪZn2+ ��NH4+�� CO32-�������������Һ��pH=6-6.5����Zn2(OH)2CO3����ҺΪ(NH4)2SO4 ����ȷ����(NH4)2SO4��
(5) ��ȥͭ���ӵĹ�����������п�ۣ�����ZnO�е�пԪ�ز���ȫ������Ǧп������������Ǧп������пԪ�صĻ����ʣ����Խ���Ϊ���ܣ���ȷ�𰸣����ܣ���ȥͭ���ӵĹ�����������п�ۣ�����ZnO�е�пԪ�ز���ȫ������Ǧп������������Ǧп������пԪ�صĻ����ʡ�
(6) ������NH3��H2O�ĵ��볣��Kb=1.8��10-5����NH4+��ˮ��ƽ�ⳣ��Ϊ1��10-14/1.8��10-5,��Һ�д��ڣ�NH4++H2O=NH3��H2O+H+ ��c(NH3��H2O)��c(H+)/c(NH4+)=1��10-14/1.8��10-5,��֪��c(NH4+)��c(NH3��H2O)=18������c(H+)=10-8mol/L������ҺpHΪ8����Һ�д���HCO3-+H2O= H2CO3+OH-��̼��ĵ��볣����Ka1=4.4��10-7��Ka2=5.6��10-11����֪Kh2= c(H2CO3)��c(OH-)/c(HCO3-)=1��10-14/4.4��10-7������Ϊc(OH-)=10-6mol/L,����c(HCO3-)��c(H2CO3)=44����ȷ����8��44��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú��ɵ�S2�Ĵ����ŷ��Ѿ������ǵ����滷������������ƻ�����ѧ�о�����:һ��������,ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��ա�
��1����֪:2CO(g)+2O2(g)=2CO2g) ��H1=-566kJ/mol
S(l)+O2(g)=SO2(g) ��H2=--296kJ/mol
��Ӧ2CO(g)+SO2(g) ![]() 2CO2(g)ʮS(l) ��H=________ kJ/mol
2CO2(g)ʮS(l) ��H=________ kJ/mol
��2��ȼú��������Ļ��շ�Ӧ��ƽ�ⳣ������ʽK=_________�����¶Ⱥ��ݻ�����ʱ,����˵����ȷ����_________ (����ĸ���)
A.������ѹǿ���ٸı�ʱ,��Ӧ�ﵽƽ��״̬
B.ƽ��ʱ,������������,�������,����Ӧ���ʼӿ�
C.��n((CO)��n(SO2)��n(CO2)=2��1��2ʱ,��Ӧ�ﵽƽ��״̬
D.������������,ʹ�ò�ͬ����,�÷�Ӧƽ�ⳣ���仯
��3�������������з���������Ӧ,���������SO2ת���ʵ���_________(����ĸ���)��
A.ѡ�ø���Ч�Ĵ��� B.���߷�Ӧ��ϵ���¶�
C.���ͷ�Ӧ��ϵ���¶� D.�������������
��4��SO2β�������ķ���֮һ�ǽ�β��ֱ��ͨ��NaOH��Һ�С����� 1mol SO2����ͨ��1L2mo1/L��NaOH��Һ��������Һ������Ũ���ɴ�С��˳��Ϊ_____________��
��5��β���е�CO�����Ƴ�CO-----����ȼ�ϵ�ء�CO----����ȼ�ϵ����ʹ�õĵ�����Dz���Y2O3��ZrO2����,���ڸ������ܴ���O2�����õ�ظ����ĵ缫��ӦʽΪ_______________���ܷ�ӦʽΪ__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮϵ�����ӵ�ع���ԭ������ͼ��ʾ��TiO2��缫��ʹ�����̫�������³�磬���ʱNa2S4��ԭΪNa2S������˵���������
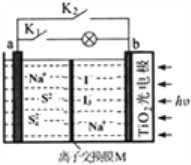
A. �ر�K2��K1ʱ����װ��ʵ��̫����ת��Ϊ���ܣ���ת��Ϊ��ѧ��
B. M�������ӽ���Ĥ.
C. ���ʱ�������ĵ缫��ӦʽΪ��3I--2e-=I3-
D. �ŵ�ʱ��b����������Ũ�ȼ�С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�����ڱ���һ����,����EΪ�ؿ��к�����ߵ�Ԫ�ء�

�������������:
��1��DԪ����Ԫ�����ڱ��е�λ��______________��
��2��A��E�����ӵİ뾶�ɴ�С˳��Ϊ___________(�þ���������ű�ʾ,��ͬ)��
��3��д��A��F����Ԫ�ص�����������ˮ�������Ӧ�����ӷ���ʽ_________��
��4��д��������C�����������ͨ�뺬B������Һ�е����ӷ���ʽ____________��
��5��֤��Ԫ��F��G�ķǽ�����ǿ��(�û�ѧ����ʽ��ʾ)___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������100mL 0.10molL��1��CuSO4��Һ�����²���1��5�������ƵĹ��̼�ʾ��ͼ��
����1��ȷ��ȡһ�������ĵ������岢����������ˮ�ܽ⣻
����2����������Һת�Ƶ�����X�У�������ˮ��ϴ�ձ��Ͳ�����2��3�Σ���ϴ��ҺҲת�Ƶ�X�У�
����3��������X�м�����ˮ��Һ����X�Ŀ̶���l��2cm����
����4������5����ͼ
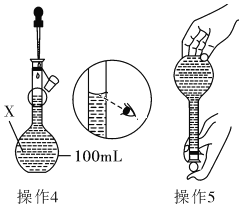
��1������X��������______________��
��2������1�У�Ӧ��ȡ�������������Ϊ_____________��
��3������������������ȷ�����ݲ���4�������ҺŨ��__��ѡ�ƫ����ƫС��������Ӱ�족�����жϡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ�־��ж���ҩ��ѧ���ԵĻ���ͪ��ҩ�ʵ�����ɷ��㻯����A�Ʊ�G�ĺϳ�·�����£�
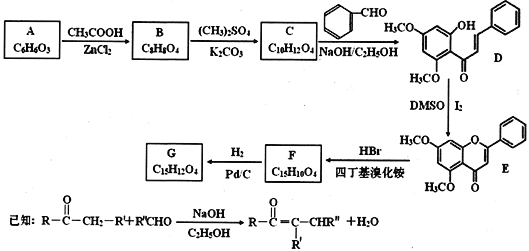
�ش��������⣺
(1)A�еĹ���������Ϊ________________��E�ķ���ʽΪ________________��
(2)��A����B����F����G�ķ�Ӧ���ͷֱ���________________��____________��
(3)��C����D�Ļ�ѧ����ʽΪ____________________��
(4)G�Ľṹ��ʽΪ____________________��
(5)���㻯����X��B��ͬ���칹�壬����FeCl3��Һ������ɫ��Ӧ��1molX����4 mol NaOH��Ӧ����˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ3��2��2��1��д��һ�ַ���Ҫ���X�Ľṹ��ʽ____________��
(6)д���û���ϩ������ȩΪԭ���Ʊ�������![]() �ĺϳ�·��(�����Լ���ѡ)��__
�ĺϳ�·��(�����Լ���ѡ)��__
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬�ĵ���һϵ��ת�����Ƶ����ᣬ����ͼ��ʾ��

��1��������������һ��������Ӧ�Ļ�ѧ����ʽ��______________��
��2����800��ʱ�����ݻ�Ϊ1L���ܱ������г���0.020 mol NO��0.010 mol O2��������Ӧ2NO��g����O2��g��![]() 2NO2��g������Ӧ������O2��Ũ����ʱ��仯�������ͼ��ʾ��
2NO2��g������Ӧ������O2��Ũ����ʱ��仯�������ͼ��ʾ��

��2minʱ��c��NO2����_________mol/L��
��800��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ����ֵ��__________��
����֪��

NO����NO2�Ȼ�ѧ����ʽ��_________��Ϊ�����NO��ת���ʿ��Բ�ȡ�Ĵ�ʩ��__________��
��3�����õ�ⷨ��������������ķ�����ʵ����ģ���ⷨ����NO��װ����ͼ��ʾ����Ϊʯī�缫������������NOת��Ϊ����ĵ缫��Ӧʽ��__________����������״����448 L��NO����ɵõ���������Ϊ63����HNO3��Һ��������____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������( )

A. ͼ�ױ�ʾ��CH3COOH��Һ������CH3COONa�������ҺpH�ı仯
B. ͼ�ұ�ʾ��CH3COOH��Һ�м�ˮʱ��Һ�ĵ����Ա仯����CH3COOH��Һ��pH��a>b
C. ͼ����ʾ�����ܸı仯ѧ��Ӧ���ʱ�
D. ͼ����ʾ����NO2���ݻ���ͬ�ĺ����ܱ������У���ͬ�¶��·ֱ�����Ӧ��2NO2(g)![]() N2O4(g)����ͬʱ�����NO2���������ߣ���÷�Ӧ����H<0
N2O4(g)����ͬʱ�����NO2���������ߣ���÷�Ӧ����H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ѧʵ��С��̽��Na2O2�ܷ���CO2��Ӧ����O2�������µ�ʵ��װ�ý���ʵ�飺(�ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6 mol��L-1���ᡢ6 mol��L-1���������ˮ)
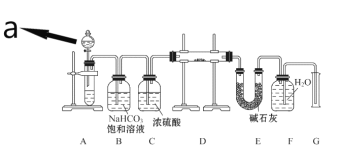
�ش��������⣺
��1������a��������____________��a��Һ���Լ�Ӧѡ��_____________(�6 mol��L-1���ᡱ��6 mol��L-1���ᡱ)��
��2��װ��B��������______________��װ��C��������_____________��
��3��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��__________________________��
��4��װ��E�м�ʯ�ҵ�������_________________________________��
��5����ʵ��װ���У����֤��Na2O2��CO2��Ӧ�ܷ�����O2____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com