
【题目】某中学化学实验小组探究Na2O2能否与CO2反应生成O2,用如下的实验装置进行实验:(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
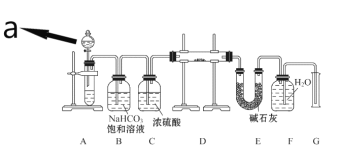
回答下列问题:
(1)仪器a的名称是____________,a中液体试剂应选用_____________(填“6 mol·L-1盐酸”或“6 mol·L-1硫酸”)。
(2)装置B的作用是______________,装置C的作用是_____________。
(3)装置D中发生反应的化学方程式是__________________________。
(4)装置E中碱石灰的作用是_________________________________。
(5)该实验装置中,如何证明Na2O2与CO2反应能否生成O2____________。
【答案】分液漏斗 6 mol·L-1盐酸 除去气体中的HCl 干燥气体 2Na2O2+2CO2=2Na2CO3+O2 吸收装置D中反应剩余的CO2 反应完毕后,将带火星的木条伸入F瓶中,如带火星的木条复燃,说明Na2O2与CO2反应生成O2
【解析】
A用于制备二氧化碳,B用于除去HCl,C起到干燥作用,在D中反应生成氧气,E用于除去二氧化碳,然后用排水法收集氧气,据此解答该题。
(1)根据仪器构造可知仪器a的名称是分液漏斗,装置A用来制备二氧化碳,由于硫酸钙微溶,不利于制备二氧化碳,因此a中液体试剂应选用6 mol·L-1盐酸;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体和水蒸气,可以用饱和碳酸氢钠来除去氯化氢,浓硫酸具有吸水性,可以将二氧化碳干燥,即装置B的作用是除去气体中的HCl,装置C的作用是干燥气体;
(3)装置D中过氧化钠吸收二氧化碳生成碳酸钠和氧气,发生反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;
(4)装置E中碱石灰的作用是吸收装置D中反应剩余的二氧化碳,防止对氧气的检验造成干扰。
(5)由于氧气是助燃性气体,则该实验装置中证明Na2O2与CO2反应生成O2的实验操作是反应完毕后,将带火星的木条伸入F瓶中,如带火星的木条复燃,说明Na2O2与CO2反应生成O2。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】用工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质为含Si、Fe(III)、Cu、Cd等元素的化合物)为原料,制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
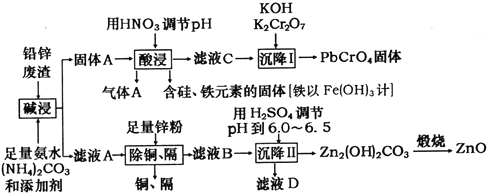
已知常温下Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=7.4×10-14,Ksp[Fe(OH)3]=1.0×10-38。
(1)“碱浸”过程中PbSO4发生反应的离子方程式为_______________________________,气体A的化学式为_________________________。
(2)“酸浸”过程中,在常温下应控制pH不低于________________________________。
(3)“沉降I”中发生沉降反应的离子方程式为____________________________。
(4)滤液D中溶质的主要成分为________________。
(5)以1t含锌元素10%的铅锌废渣制得活性氧化锌113.4kg,依据以上数据能否计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由。___________________。
(6)常温下NH3·H2O的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=5.6×10-11。该温度下某浓度的(NH4)2CO3溶液中c(NH4+)/c(NH3·H2O)=18。则溶液pH为__________________,c(HCO3-)/c(H2CO3)=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空:
(1)水的电离与溶液的酸碱性密切相关。
①常温下,某柠檬水溶液的pH=3,其中的c(OH-)=__________。
②常温下,浓度均为0.1 molL-1的CH3COOH溶液和CH3COONa溶液中,水的电离程度大小关系是:前者_____________后者(填“>”“<”或“=”);
③常温下,浓度均为0.1 molL-1的NaX和NaY两种盐溶液,其pH分别为8 和10,则HX 和HY的酸性强弱关系是:HX_________HY(填“>”或“<”)。
(2)研究化学能与电能相互转化的装置、过程和效率的科学,叫做电化学。
①某原电池装置如右图,则:
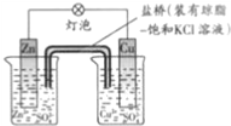
该原电池的负极是__________(填“Zn”或“Cu”),正极的电极反应式为_______________________;
②用铂电极电解某金属氯化物(XCl2)的溶液,当收集到2.24 LCl2(标准状况)时,阴极增重6.4 g,则该金属的相对原子质量为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对 0.1 mol·L-1 醋酸溶液在25 ℃下的稀释过程,不正确的是
A. 醋酸的电离平衡常数不变 B. 溶液中c(H+)减小
C. c(H+)/c(CH3COOH)增大 D. 醋酸溶液中所有离子的浓度均减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某恒温恒容密闭容器中充入0.2 mol X,发生如下反应:2X(g)![]() Y(g)+3Z(g) ΔH=a kJ·mol-1(a>0)。下列说法正确的是
Y(g)+3Z(g) ΔH=a kJ·mol-1(a>0)。下列说法正确的是
A. 增大X的浓度,正反应速率增大,逆反应速率减小
B. 当混合气体的密度不再变化时,该反应达到化学平衡状态
C. 达到化学平衡状态时,共吸收 0.1a kJ的热量
D. 若平衡后再向反应器中充入 0.2 mol X,达平衡后,X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
H-H | N-H | N-N | N≡N |
435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、CO32-、SO42-、NO3-中的若干种离子,离子浓度均为0.1mol/L,某同学进行如下实验。下列说法正确的是

A. 无法确定沉淀C 的成分
B. 无法确定原试液中是否存在K+、Al3+、Cl-、
C. 试液中可能含有CO32-、K+、NH4+
D. 试液中一定存在的离子为NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com