
����Ŀ����ij���º����ܱ������г���0.2 mol X���������·�Ӧ��2X(g)![]() Y(g)+3Z(g) ��H��a kJ��mol-1(a>0)������˵����ȷ����
Y(g)+3Z(g) ��H��a kJ��mol-1(a>0)������˵����ȷ����
A. ����X��Ũ�ȣ�����Ӧ���������淴Ӧ���ʼ�С
B. �����������ܶȲ��ٱ仯ʱ���÷�Ӧ�ﵽ��ѧƽ��״̬
C. �ﵽ��ѧƽ��״̬ʱ�������� 0.1a kJ������
D. ��ƽ�������Ӧ���г��� 0.2 mol X����ƽ���X��ת���ʼ�С
���𰸡�D
��������A������X��Ũ�ȣ�����Ӧ�������ı��˲�䣬�������Ũ�Ȳ��䣬�淴Ӧ���ʲ��䣬���ŷ�Ӧ���У��淴Ӧ��������A����B�������ܶȵĶ��壬��ֶ������壬�����������������䣬����Ϊ����״̬��������������䣬����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��B����C���˷�Ӧ�ǿ��淴Ӧ��������Ŀ��Ϣ������������յ���������C����D���ٳ���0.2molX���൱����ԭ���Ļ���������ѹǿ����X��ת���ʼ�С����D��ȷ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������100mL 0.10molL��1��CuSO4��Һ�����²���1��5�������ƵĹ��̼�ʾ��ͼ��
����1��ȷ��ȡһ�������ĵ������岢����������ˮ�ܽ⣻
����2����������Һת�Ƶ�����X�У�������ˮ��ϴ�ձ��Ͳ�����2��3�Σ���ϴ��ҺҲת�Ƶ�X�У�
����3��������X�м�����ˮ��Һ����X�Ŀ̶���l��2cm����
����4������5����ͼ
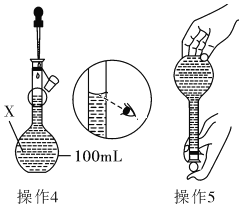
��1������X��������______________��
��2������1�У�Ӧ��ȡ�������������Ϊ_____________��
��3������������������ȷ�����ݲ���4�������ҺŨ��__��ѡ�ƫ����ƫС��������Ӱ�족�����жϡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȩ��һ�����������.��ϳ�·��������
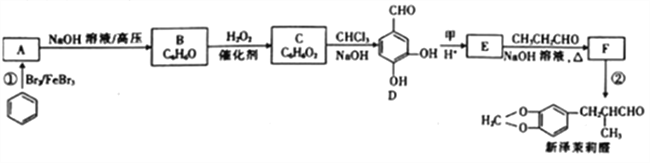
��֪:��RCHO+R'CH2CHO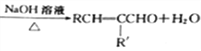
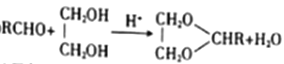
��
��1����֪����Է�������Ϊ30���Ľṹ��ʽΪ____��E�к��������ŵ�������____��
��2����Ӧ���ķ�Ӧ������____ ��
��3��д����Ӧ���Ļ�ѧ����ʽ:_________________��
��4�������廯����G��E��Ϊͬ���칹�壬1molG��������NaHCO3��Һ��Ӧ����1mol��������G�ܷ���������Ӧ����G�Ľṹ��______��������һ�ֽṹ�����ϵ�һ�ȴ������������ұ�����������C��Ӧ���ɸ߷��ӻ����д���ø߷��ӻ�����Ľṹ��ʽ:_______��
��5�������֪����������Ҵ��ͱ���ȩ![]() Ϊԭ��(���Լ���ѡ)�Ʊ�
Ϊԭ��(���Լ���ѡ)�Ʊ�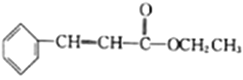 �ĺϳ�·��(�ýṹ��ʽ��ʾ�л������ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����):__________________��
�ĺϳ�·��(�ýṹ��ʽ��ʾ�л������ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����):__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ���ǣ� ��
A. ��Ũ����ֱ��MnO2��KClO3��Ӧ�Ʊ�1mol������ת�Ƶĵ�������Ϊ2NA
B. 1 mol H2O�����γ�4NA�����
C. �����£�1L pH=2��H2SO4��Һ�У������ˮ�����H+����Ϊ0.01NA
D. ���³�ѹ�£�NO2��N2O4�Ļ������46g��ԭ������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���й���������ȷ����
��� | �� | �� | �� | �� |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. �ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B. �ڢ�����Һ�������ϣ�������Һ��c��H+��>c��OH-��
C. �ֱ��ˮϡ��10����������Һ��pH����>��>��>��
D. �������Һ�У�ˮ�ĵ���̶ȣ���>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ѧʵ��С��̽��Na2O2�ܷ���CO2��Ӧ����O2�������µ�ʵ��װ�ý���ʵ�飺(�ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6 mol��L-1���ᡢ6 mol��L-1���������ˮ)
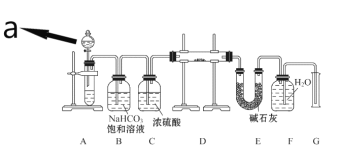
�ش��������⣺
��1������a��������____________��a��Һ���Լ�Ӧѡ��_____________(�6 mol��L-1���ᡱ��6 mol��L-1���ᡱ)��
��2��װ��B��������______________��װ��C��������_____________��
��3��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��__________________________��
��4��װ��E�м�ʯ�ҵ�������_________________________________��
��5����ʵ��װ���У����֤��Na2O2��CO2��Ӧ�ܷ�����O2____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A. 5NH4NO3![]() 2HNO3��4N2����9H2O��Ӧ�У�����28gN2��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3��4N2����9H2O��Ӧ�У�����28gN2��ת�Ƶĵ�����ĿΪ3.75NA
B. �����£�0.2mol��L-1��Na2SO4��Һ�к�Na+��ĿΪ0.4NA
C. ��״���£�NA��HF������ռ�����ԼΪ22.4L
D. �����£�0.2molFe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ij���������Է�ˮ���������Ӽ���Ũ�����±���ʾ��
���� | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
Ũ��/(mol/L) | 2��10-3 | 1��10-3 | 1��10-2 | 2��10-3 |
��1��c(H+)= mol/L��
��2��Ϊ�˼�����Ⱦ�����Ϊ��������ʦ��������������̣�����ͭ���̷���FeSO4��7H2O����

�� ��ҵ��ˮ�м������ۺ�Ӧ�����ӷ���ʽΪ��
Fe + Cu2+ == Fe2+ + Cu�� �� ��
�� �Լ�B�� ��
�� ������������Ũ������ȴ�ᾧ�� �������������ˮϴ�Ӿ��壬�ڵ����¸��
�� ͨ��������ҺD��Fe3+���жϷ�ˮ��Fe3+�Ƿ������ʵ�鷽���� ��
�� ��õ�FeSO4��7H2O���ܱձ��棬ԭ���� ��
�� ����1000 L��ˮ���������ɻ�� FeSO4��7H2O�����ʵ����� mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ԫ�ص�ԭ�������Ĵ�С˳��ΪC��A��B��D��E�����У�A��Cͬ���ڣ�B��Cͬ���壻A��B �γ����ӻ�����A2B��A2B���������ӵĵ�������ͬ�����������Ϊ30��D��E���γ�4��10���ӷ��ӡ��Իش��������⣺
(1)����Ԫ��C��ԭ�ӽṹʾ��ͼ��________��
(2)д��Ԫ��D��Ԫ�����ڱ��е�λ�ã���____���ڣ���____�壻��Ԫ���γɵĵ��ʵĽṹʽΪ______��
(3)д���������ʵĵ���ʽ��A��B��E�γɵĻ�����______��D��E�γɵĻ�����______��
(4)D��E�γɵĻ������������������յ��������ڿ˷�________��
(5)A��B��Ԫ����ɵĻ�����A2B2����______(����ӡ����ۡ�)���������ڵĻ�ѧ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com