
����Ŀ��������������{[CH3CH(OH)COO]2Fe��3H2O}(��Է���������288)����������FeCO3��Ӧ�Ƶã���������ˮ����һ�ֺܺõIJ�������
I���Ʊ�̼��������װ����ͼ��ʾ��

(1)����B��������____________��
(2)ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬��Ŀ���ǣ�_________��Ȼ��رջ���1���������IJ����ǣ�_________________��C�з�����Ӧ�����ӷ���ʽΪ_______________________________��
���Ʊ�����������
����FeCO3�����������������Һ����75���½���ʹ֮��ַ�Ӧ��
(3)�÷�Ӧ����ʽΪ_______________________________________��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ����______________________����Ӧ������������Һ��������������������ȴ�ᾧ�����ˡ�ϴ�ӡ�����������������塣�þ�����ʱӦע��_______��
III�������������崿�ȵIJ�����
(4)��λͬѧ�ֱ��ò�ͬ�������вⶨ��
�ټ�ͬѧͨ��KMnO4�ζ����ⶨ��Ʒ��Fe2+�ĺ���������Ʒ���ȣ����ô������Ǵ���100������ԭ�������________________________________��
����ͬѧ�������������(NH4)4Ce(SO4)4�ζ����ⶨ��Ʒ��Fe2+�ĺ���������Ʒ����(��Ӧ��Ce4+��ԭΪCe3+)����ȡ6.00g��Ʒ���Ƴ�250.00mL��Һ��ȡ25.00mL��0.10mol��L-1(NH4)4Ce(SO4)4����Һ�ζ����յ㣬���ı�Һ20.00mL�����Ʒ��������������Ĵ���Ϊ__________(������������ʾ)��
���𰸡� ������ƿ �ž�װ���ڵĿ�������ֹ������������ �رջ���3������2 Fe2++2HCO3��=FeCO3��+CO2��+H2O 2CH3CH(OH)COOH+FeCO3![]() [CH3CH(OH)COO]2Fe+CO2��+H2O �������� �ܷⱣ�� ��������ǻ�(��OH)�ܱ����Ը��������Һ�������������ĸ��������Һƫ�� 96%
[CH3CH(OH)COO]2Fe+CO2��+H2O �������� �ܷⱣ�� ��������ǻ�(��OH)�ܱ����Ը��������Һ�������������ĸ��������Һƫ�� 96%
���������������������к����������ӣ��ױ������е�����������������Ʊ�������������������ʱ��һ��Ҫ�ų�������Ӱ�죻ʵ�鿪ʼǰ��Ҫ��ͨ�������ž�װ���ڵĿ�����Ȼ����������������ѹǿ�������������Һѹ�뵽��Ӧ���н��з�Ӧ������̼��������̼�������������ᷴӦ�����������������������۷�ֹ�����������õ����غ���ɽ��������������Ȳⶨʱ�������е��ǻ�Ҳ�ܱ����Ը��������Һ�����������ʵ�����ݴ˷������⡣
(1) ����B����������Һ��ģ�Ϊ������ƿ����ȷ�𰸣�������ƿ��
(2) Ϊ˳�����ʵ��Ŀ�ģ��ȹرջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬�����������ܹ���װ���ڵĿ����ž�����ֹ�������ӱ�������Ȼ��رջ���1���رջ���3������2���������ɵ�������ʹBװ���е���ѹ����Bװ���е�����������Һѹ�뵽Cװ��������̼�������Һ������Ӧ������̼�������Ͷ�����̼�����ӷ���ʽΪFe2++2HCO3��=FeCO3��+CO2��+H2O����ȷ�𰸣��ž�װ���ڵĿ�������ֹ�������������� �رջ���3������2 ��Fe2++2HCO3��=FeCO3��+CO2��+H2O��
(3) ����FeCO3�����������������Һ����75���½���ʹ֮��ַ�Ӧ���������������Ͷ�����̼���÷�Ӧ����ʽΪ2CH3CH(OH)COOH+FeCO3![]() [CH3CH(OH)COO]2Fe+CO2��+H2O��Ϊ��ֹ�����������ʣ��������ۣ���ֹ�䱻��������Ӧ�����õ��������������壬�����������ӣ��ױ����������Ҫ���������ܷⱣ�棻��ȷ�𰸣�2CH3CH(OH)COOH+FeCO3
[CH3CH(OH)COO]2Fe+CO2��+H2O��Ϊ��ֹ�����������ʣ��������ۣ���ֹ�䱻��������Ӧ�����õ��������������壬�����������ӣ��ױ����������Ҫ���������ܷⱣ�棻��ȷ�𰸣�2CH3CH(OH)COOH+FeCO3![]() [CH3CH(OH)COO]2Fe+CO2��+H2O �� �������ۣ� �ܷⱣ�档
[CH3CH(OH)COO]2Fe+CO2��+H2O �� �������ۣ� �ܷⱣ�档
(4)��������к����ǻ������ܱ����Ը��������Һ�������������ĵĸ�����ص�����࣬�������а�Fe2+���������ʼ������õ���������������ƫ��Ʒ�����������Ĵ��ȴ���100������ȷ�𰸣���������ǻ�(��OH)�ܱ����Ը��������Һ�������������ĸ��������Һƫ�ࡣ
��Ce4+��Ce3+������ԭ��Ӧ���õ�������Ϊ250/25��0.10��20��10-3mol,���������ӵ���Ϊx mol���������ӷ���������Ӧ�����������ӣ�ʧ��������Ϊx��1 mol,����������ԭ��Ӧ���ӵ�ʧ�غ���ɣ�x��1=250/25��0.10��20��10-3��x=2��10-2 mol���������غ㣬���������������Ϊ2��10-2 mol��������Ϊ2��10-2��288g, ���Ʒ��������������Ĵ���Ϊ2��10-2��288/6.00��100%=96%����ȷ�𰸣�96%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿��������������ӵ�صĸ������ϡ��������·�Ӧ�Ƶ������̣�4Mn(NO3)2��6H2O+26(CH3CO)2O ��4(CH3COO)3Mn +8HNO2+ 3O2��+40CH3COOH
��1��Mn3+��̬��������Ų�ʽΪ______��
��2��NO�е�ԭ�ӹ�����ӻ�������______��
��3����HNO2��Ϊ�ȵ������һ�������ӵĻ�ѧʽΪ______��
��4�������[Mn(CH3OH)6]2+���ṩ�¶Ե��ӵ�ԭ����______��
��5��CH3COOH����H2O����Ȼ��ܵ�ԭ�����Ƕ��Ǽ��Է������______��
��6��þ���Ͻ����´����һ�ִ��Ʋ��ϣ��侧��Ϊ�����ṹ����ͼ��ʾ����ͼ��ԭ��λ�ڶ�������ġ��þ�����ÿ����ԭ����Χ���������þԭ����ĿΪ______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B������ͬ�����ʣ�����H��N��O��Na�е���������Ԫ����ɵ�ǿ����ʣ�A��ˮ��Һ�ʼ��ԣ�B��ˮ��Һ�����ԣ����ҳ�A��B���ܵ�������ϡ�Ҫ����ͬŨ��ʱ��A1��Һ��ˮ�ĵ���̶�С��A2��Һ��ˮ�ĵ���̶ȣ���ͬŨ��ʱ��B1��Һ��ˮ�ĵ���̶�С��B2��Һ��ˮ�ĵ���̶ȡ���˵���� ![]() ���ȶ��������ǣ�
���ȶ��������ǣ�
����д���пհף�
��1��д����ѧʽ��A1___________��A2__________��B1___________��B2___________��
��2����֪�� ![]() ����
����![]() ��
��![]() �������������Һ������Ũ���ɴ�С��˳��Ϊ______________________��
�������������Һ������Ũ���ɴ�С��˳��Ϊ______________________��
��3��B1��Һ��ˮ�ĵ���̶�С��B2��Һ��ˮ�ĵ���̶ȣ�ԭ����_________________��
��4�������£���B1��B2������Һ��pH��5��������Һ����ˮ������������ӵ����ʵ���Ũ��֮��Ϊ________��
��5�������£� ![]() ��
��![]() ��Һ��
��Һ��![]() ����
����![]() �ĵ���ƽ�ⳣ��Ka_______________��
�ĵ���ƽ�ⳣ��Ka_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������γ������������ף���������(��Ҫ�ɷ�ΪSO2)�Ĵ������ܹ�ע����Ҫ���������ַ�������ش��������⣺
��.��Һ���շ�
����1����������ˮ����SO2��
����2���ټ�����ʯ�ң�������Ӧ2NH��Ca2����2OH����SO![]() ===CaSO3����2NH3��H2O��
===CaSO3����2NH3��H2O��
(1)��֪��25 ��ʱ��Kb(NH3��H2O)��a��Ksp(CaSO3)��b�����¶��£�����2�з�Ӧ��ƽ�ⳣ��K��__________(�ú�a��b�Ĵ���ʽ��ʾ)��
��.ˮú����ԭ��
��֪����.2CO(g)��SO2(g) ![]() S(l)��2CO2(g)�� ��H1����37.0 kJ��mol��1
S(l)��2CO2(g)�� ��H1����37.0 kJ��mol��1
��.2H2(g)��SO2(g) ![]() S(l)��2H2O(g)�� ��H2����45.4 kJ��mol��1
S(l)��2H2O(g)�� ��H2����45.4 kJ��mol��1
(2)д��CO(g)��H2O(g)��Ӧ����CO2(g) ��H2(g)���Ȼ�ѧ����ʽΪ_______________��
���÷�Ӧ�ھ��ȡ�������ϵ�н��У��ﵽƽ��ı�־___________��
A.�������Ķ������ʵ���������Ķ�������
B.��������ƽ��Ħ���������ֲ���
C.����������ѹǿ���ֲ���
D. H2O(g) ��H2(g)������ȱ��ֲ���
(3)��Ӧ��������Ӧ�Ļ��E________(�>����<������)��H2��
(4)��һ��ѹǿ�£�������Ӧ����ƽ��ʱ����(SO2) �����������ת���ʣ���ԭ����Ͷ�ϱ�[![]() ]���¶�(T)�Ĺ�ϵ��ͼ��ʾ��
]���¶�(T)�Ĺ�ϵ��ͼ��ʾ��

����(H2)��M________(�>����<������)N��
���淴Ӧ���ʣ�M________(�>����<������)Q��
(5)T �棬��10 L�����ܱ������г���2 mol CO(g)��2 mol SO2(g)��2 mol H2(g)��������Ӧ���ͷ�Ӧ����5 min�ﵽƽ��ʱ��CO2(g)��H2O(g)�����ʵ����ֱ�Ϊ1.6 mol��1.8 mol��
�ٸ��¶��£���Ӧ����ƽ�ⳣ��K��________��
�������������䣬6 minʱ��С�����ݻ�����(SO2)__________(�������С�����䡱)��ԭ��Ϊ_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1.000 mol/L�������20.00 mL 1.000 mol/L��ˮ�У���ҺpH���¶��������������仯������ͼ��ʾ�������й�˵����ȷ����

A. d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
B. a����ˮ�������c��H������1.0![]() mol/L
mol/L
C. b�㣺c��NH![]() ����c��NH3��H2O����c��Cl����
����c��NH3��H2O����c��Cl����
D. c�㣺c��Cl������c��NH![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������100mL 0.10molL��1��CuSO4��Һ�����²���1��5�������ƵĹ��̼�ʾ��ͼ��
����1��ȷ��ȡһ�������ĵ������岢����������ˮ�ܽ⣻
����2����������Һת�Ƶ�����X�У�������ˮ��ϴ�ձ��Ͳ�����2��3�Σ���ϴ��ҺҲת�Ƶ�X�У�
����3��������X�м�����ˮ��Һ����X�Ŀ̶���l��2cm����
����4������5����ͼ
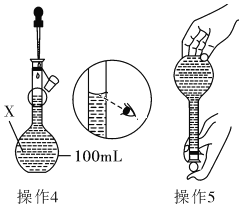
��1������X��������______________��
��2������1�У�Ӧ��ȡ�������������Ϊ_____________��
��3������������������ȷ�����ݲ���4�������ҺŨ��__��ѡ�ƫ����ƫС��������Ӱ�족�����жϡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������(Fe3+)���������Ų�ʽΪ______��������______�ֲ�ͬ�˶�״̬�ĵ��ӡ�
(2)�����顢������Ԫ�صĵ�һ�����ܴӴ�С��˳��Ϊ___________(��Ԫ�ط��ű�ʾ)��
(3)������������̬�⻯��PH3��NH3�ļ��Ƿֱ�Ϊ93.6���107�㣬�Է���PH3�ļ���С��NH3��ԭ��_____________________________________________________________��
(4)������PCl5�ǰ�ɫ���壬��148��ʱ�ۻ����ܵ�������塣��������A��B���������ɣ�A��B�ֱ���CCl4��SF6��Ϊ�ȵ����壬��A�Ļ�ѧʽΪ__________________��������ԭ���ӻ���ʽΪ_______________��
(5)Cu��Au��ij�ֺϽ���γ������������ܶѻ��ľ���(�ܶ�Ϊ��g��cm-3)���ڸþ�����Cuԭ�Ӵ������ģ���NA��ʾ�����ӵ�������ֵ��


����Au���������Cu����Ϊ________��
�ڸþ�����д���ܣ���ԭ���ɽ��뵽Cuԭ����Auԭ�ӹ��ɵ��������϶�У������ľ����ṹ����ʯ�����ṹ(��ͼ)���ƣ��þ��崢���Ļ�ѧʽΪ__________������Cuԭ����Auԭ�����ĵ���̾���d=________cm������������ǰ��������仯����ô�����ϵĴ�������Ϊ__________��![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ̬N2O4�ǻ���ƽ�ϵͳ����Ч��������ʵ�����Ʊ�����N2O4���������£�
![]()
���з�����ȷ����
A. ��Ӧ�١����е�Ԫ�صĻ��ϼ۷����˱仯
B. ��Ӧ��������NH3��������
C. ��Ӧ�ܵ���ɫ�仯���ɻ�ѧƽ���ƶ������
D. ��Ӧ�ٿ���ͼ��ʾװ��ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���й���������ȷ����
��� | �� | �� | �� | �� |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. �ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B. �ڢ�����Һ�������ϣ�������Һ��c��H+��>c��OH-��
C. �ֱ��ˮϡ��10����������Һ��pH����>��>��>��
D. �������Һ�У�ˮ�ĵ���̶ȣ���>��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com