
【题目】微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
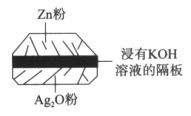
(1)该电池属于__________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是____________。
(3)使用时,负极区的pH_______(填“增大”、“减小”或“不变”,下同),电解质溶液的pH__________。
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1) 2017年10月22日,沪通长江大桥天生港航道桥主拱结构成功合龙。
①桥墩建造需要用到大量水泥。生产水泥的主要原料为黏土和____(填字母)。
a. 纯碱 b. 石灰石 c. 食盐

②氯丁橡胶作为桥梁支座,其作用是将桥跨结构上的荷载传递给墩台。氯丁橡胶属于____(填字母)。
a. 无机非金属材料
b. 金属材料
c. 有机高分子材料
③桥梁建造需要使用大量钢材,其中预埋钢板及上、下钢板均采用镀锌钢板,钢板镀锌的主要目的是____(填字母)。
a. 美化桥梁 b. 提高硬度 c. 提高耐腐蚀性
(2)洋蓟被人们冠以“蔬菜之皇”的美称,含有脂肪、蛋白质、糖类、维生素A、维生素C和丰富的钙、磷、铁等元素,其中:

①属于脂溶性维生素的是____。
②属于人体所需微量元素的是____。
③脂肪在人体内水解生成高级脂肪酸和____;糖类在人体中水解生成葡萄糖,写出葡萄糖在人体内氧化的化学方程式: ____。
(3)合理利用自然资源,防止环境污染和生态破坏。
①向燃煤中加入适量石灰石,可大大减少______的排放。煤的气化是实现能源清洁化的重要途径,水煤气的主要成分是CO和______。
②明矾是一种常用的混凝剂,其净水原理是___________(用离子方程式表示)。
③我国科学家证明了黄粉虫的幼虫可降解聚苯乙烯(![]() )这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:________________。防治废塑料制品造成的白色污染,还可以采用的方法有:__________(任写一种)。
)这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:________________。防治废塑料制品造成的白色污染,还可以采用的方法有:__________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH+Ca2++2OH-+SO![]() ===CaSO3↓+2NH3·H2O。
===CaSO3↓+2NH3·H2O。
(1)已知:25 ℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=__________(用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
ⅱ.2H2(g)+SO2(g) ![]() S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
(2)写出CO(g)与H2O(g)反应生成CO2(g) 、H2(g)的热化学方程式为_______________。
若该反应在绝热、恒容体系中进行,达到平衡的标志___________。
A.氢氧键的断裂速率等于氢氢键的断裂速率
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D. H2O(g) 与H2(g)的体积比保持不变
(3)反应ⅱ的正反应的活化能E________(填“>”“<”或“=”)ΔH2。
(4)在一定压强下,发生反应ⅱ。平衡时,α(SO2) (二氧化硫的转化率)与原料气投料比[![]() ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。

①α(H2):M________(填“>”“<”或“=”)N。
②逆反应速率:M________(填“>”“<”或“=”)Q。
(5)T ℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol SO2(g)和2 mol H2(g),发生反应ⅰ和反应ⅱ。5 min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应ⅱ的平衡常数K=________。
②其他条件不变,6 min时缩小容器容积。α(SO2)__________(填“增大”“减小”或“不变”),原因为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解;
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中;
操作3:继续向X中加蒸馏水至液面离X的刻度线l~2cm处;
操作4、操作5:见图
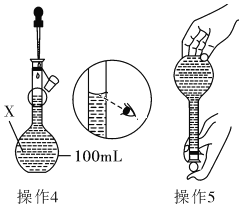
(1)仪器X的名称是______________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度__(选填“偏大”、“偏小”、“无影响”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。
(2)硒、砷、溴三种元素的第一电离能从大到小的顺序为___________(用元素符号表示)。
(3)两种三角锥形气态氢化物PH3和NH3的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_____________________________________________________________。
(4)常温下PCl5是白色晶体,在148℃时熔化成能导电的熔体。该熔体由A、B两种微粒构成,A、B分别与CCl4、SF6互为等电子体,则A的化学式为__________________,其中心原子杂化方式为_______________。
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为ρg·cm-3),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。


①与Au距离最近的Cu个数为________。
②该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为__________,则晶胞中Cu原子与Au原子中心的最短距离d=________cm。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为__________(![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。

①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:

NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态N2O4是火箭推进系统的有效氧化剂。实验室制备少量N2O4的流程如下:
![]()
下列分析正确的是
A. 反应①、③中氮元素的化合价发生了变化
B. 反应②利用了NH3的氧化性
C. 反应④的颜色变化是由化学平衡移动引起的
D. 反应①可由图所示装置实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
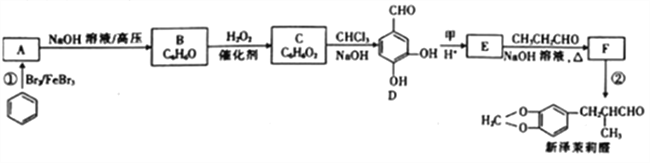
已知:①RCHO+R'CH2CHO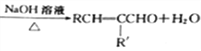
②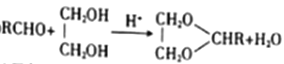
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备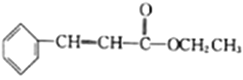 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com