
����Ŀ����ͼ�Ƕ����ѽ��ʵ�����̣�����ʾ��������һ���������ѽ�Ŀ��ܷ���ʽΪ��C4H10![]() C2H6+C2H4�� C4H10
C2H6+C2H4�� C4H10![]() CH4+C3H6��
CH4+C3H6��
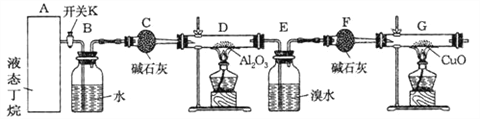
���Ӻ�װ�ú�����е�ʵ������У�
�ٸ�D��Gװ�ü��ȣ��ڼ������װ�õ������ԣ����ų�װ���еĿ�������
��1���������������Ⱥ�˳��������_______________________������ţ�
��2��д������������ͭ��Ӧ�Ļ�ѧ����ʽ______________________
��3������Eװ���еĻ�����ˮ���������ٰ���������ʵ�飺
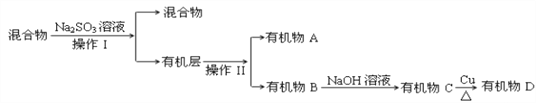
�ٷ�����������������Ʒֱ��ǣ���________��________��Na2SO3��Һ�������ǣ������ӷ���ʽ��ʾ��________________________________________________________��
����֪B��̼ԭ��������A��̼ԭ��������д��B�Ľṹ��ʽ_____________________��
��4���ٶ�������ȫ�ѽ�������E+F��װ�õ��������ȷ�Ӧǰ������0��7 g�� Gװ�õ�����������1��76 g��������ѽ�����м������������ʵ���֮�� n��CH4��: n��C2H6��=__________��
���𰸡� ���� ���� �� CH4+4CuO![]() CO2+2H2O+4Cu ��Һ ����
CO2+2H2O+4Cu ��Һ ���� ![]()
![]() 1��1
1��1
����������K������ͨ��B��Bװ���Ǹ������ݿ����������٣�Cװ�ø��ﶡ�飬�������������������¶��鷢���ѽⷴӦ����ϩ����������E����ˮ����ϩ����F����������G��������Cu�ڼ��������·���������ԭ��Ӧ����Cu��
(1)Ӧ�ȼ��������ԣ��ϳ��ڲ����壬�ٸ�D��Gװ�ü��ȣ��ʴ�Ϊ���ڢۢ���
(2)�����������������������£����������ͭ��Ӧ���ɶ�����̼��ˮ��ͭ����Ӧ����ʽΪ��CH4+4CuO![]() CO2+2H2O+4Cu���ʴ�Ϊ��CH4+4CuO
CO2+2H2O+4Cu���ʴ�Ϊ��CH4+4CuO![]() CO2+2H2O+4Cu��
CO2+2H2O+4Cu��
(3)������к����塢ˮ��������������������ƣ��������Ʊ����������������ƣ�ͬʱ����NaBr���Ӷ���ȥ�壬Ȼ����÷�Һ�������룬���л�����з���õ��л���A���л���B�����л����м���NaOH��Һ���õ��л���C��C�ܷ���������Ӧ����B����ˮ�ⷴӦ����CΪ����C���������õ�ȩD��
��ͨ�����Ϸ���֪�����������͢�����Ʒֱ��ǣ����Һ���������������ƾ��л�ԭ�ԣ��ܺ�ǿ�����������巴Ӧ����ȥ�壬���ӷ���ʽΪ��SO32-+Br2+H2O=SO42-+2Br-+2H+���ʴ�Ϊ����Һ������SO32-+Br2+H2O=SO42-+2Br-+2H+��
����֪B��̼ԭ��������A��̼ԭ������˵��B��̼ԭ�Ӹ�����3��A��̼ԭ�Ӹ�����2��BΪ1��2-������飬B�Ľṹ��ʽCH2BrCHBrCH3���ʴ�Ϊ��CH2BrCHBrCH3��
(4)������ѽ������ɵ���ϩ����������ʵ�����ȣ����ɵļ���ͱ�ϩ�����ʵ�����ȣ�E��F���յ���ϩ����G���ٵ�����������ͭ�е���Ԫ����������xΪC2H4�����ʵ�����yΪC3H6�����ʵ�����������ͼ�������ʵ����ֱ���x��y��28x+42y=0.7g������ͼ��������ͭ��Ӧ��Ҫ����ԭ�ӵ����ʵ���Ϊ2(2x+y)+ ![]() =
=![]() ����ã�x=y=0.07mol���ʴ�Ϊ��1��1��
����ã�x=y=0.07mol���ʴ�Ϊ��1��1��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A��B��C��D��E��F��һ�������µĹ�ϵ����ͼ��ʾ�����������ʵ���ɫ��Ӧ���ʻ�ɫ��
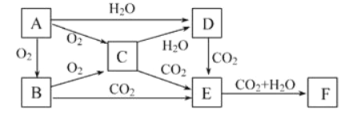
��1��д���������ʵ����ƣ�B____________��E_____��
��2��д��E��F�����ӷ���ʽ________________________��
F�����壩��E�Ļ�ѧ����ʽ_____________��
��3��д��C�������̼��Ӧ�Ļ�ѧ����ʽΪ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú��ɵ�S2�Ĵ����ŷ��Ѿ������ǵ����滷������������ƻ�����ѧ�о�����:һ��������,ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��ա�
��1����֪:2CO(g)+2O2(g)=2CO2g) ��H1=-566kJ/mol
S(l)+O2(g)=SO2(g) ��H2=--296kJ/mol
��Ӧ2CO(g)+SO2(g) ![]() 2CO2(g)ʮS(l) ��H=________ kJ/mol
2CO2(g)ʮS(l) ��H=________ kJ/mol
��2��ȼú��������Ļ��շ�Ӧ��ƽ�ⳣ������ʽK=_________�����¶Ⱥ��ݻ�����ʱ,����˵����ȷ����_________ (����ĸ���)
A.������ѹǿ���ٸı�ʱ,��Ӧ�ﵽƽ��״̬
B.ƽ��ʱ,������������,�������,����Ӧ���ʼӿ�
C.��n((CO)��n(SO2)��n(CO2)=2��1��2ʱ,��Ӧ�ﵽƽ��״̬
D.������������,ʹ�ò�ͬ����,�÷�Ӧƽ�ⳣ���仯
��3�������������з���������Ӧ,���������SO2ת���ʵ���_________(����ĸ���)��
A.ѡ�ø���Ч�Ĵ��� B.���߷�Ӧ��ϵ���¶�
C.���ͷ�Ӧ��ϵ���¶� D.�������������
��4��SO2β�������ķ���֮һ�ǽ�β��ֱ��ͨ��NaOH��Һ�С����� 1mol SO2����ͨ��1L2mo1/L��NaOH��Һ��������Һ������Ũ���ɴ�С��˳��Ϊ_____________��
��5��β���е�CO�����Ƴ�CO-----����ȼ�ϵ�ء�CO----����ȼ�ϵ����ʹ�õĵ�����Dz���Y2O3��ZrO2����,���ڸ������ܴ���O2�����õ�ظ����ĵ缫��ӦʽΪ_______________���ܷ�ӦʽΪ__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽԤ��Ŀ�ĵ���
��� | ʵ������ | ʵ��Ŀ�� |
A | ���з�̪��Na2CO3��Һ�м�������BaC12���壬��Һ��ɫ��dz | ֤��Na2CO3��Һ�д���ˮ��ƽ�� |
B | �����£���pH��ֽ�ֱ�ⶨŨ��Ϊ18mol/L��0.1 mol/L H2SO4��Һ��pH | �Ƚϲ�ͬŨ��H2SO4������ǿ�� |
C | ����FeCl2��Һʱ���Ƚ�FeCl2��������Ũ�����У���������ˮϡ�͵�����Ũ�ȣ�������Լ�ƿ�м�������ͭ�� | ����Fe2��ˮ�⣬����ֹFe2�������� |
D | ��ʢ��1mL 0.01 mol/L | ֤������ͬ�¶��µ� Ksp(AgCl)��Ksp(AgI) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��������Һ��ˮ�ĵ���̶���С����
A. pH��11�İ�ˮ B. 0.01 mol/L��Na2CO3��Һ
C. 0.01 mol/L������ D. pH��4��NaHSO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮϵ�����ӵ�ع���ԭ������ͼ��ʾ��TiO2��缫��ʹ�����̫�������³�磬���ʱNa2S4��ԭΪNa2S������˵���������
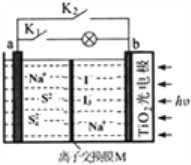
A. �ر�K2��K1ʱ����װ��ʵ��̫����ת��Ϊ���ܣ���ת��Ϊ��ѧ��
B. M�������ӽ���Ĥ.
C. ���ʱ�������ĵ缫��ӦʽΪ��3I--2e-=I3-
D. �ŵ�ʱ��b����������Ũ�ȼ�С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�����ڱ���һ����,����EΪ�ؿ��к�����ߵ�Ԫ�ء�

�������������:
��1��DԪ����Ԫ�����ڱ��е�λ��______________��
��2��A��E�����ӵİ뾶�ɴ�С˳��Ϊ___________(�þ���������ű�ʾ,��ͬ)��
��3��д��A��F����Ԫ�ص�����������ˮ�������Ӧ�����ӷ���ʽ_________��
��4��д��������C�����������ͨ�뺬B������Һ�е����ӷ���ʽ____________��
��5��֤��Ԫ��F��G�ķǽ�����ǿ��(�û�ѧ����ʽ��ʾ)___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������( )

A. ͼ�ױ�ʾ��CH3COOH��Һ������CH3COONa�������ҺpH�ı仯
B. ͼ�ұ�ʾ��CH3COOH��Һ�м�ˮʱ��Һ�ĵ����Ա仯����CH3COOH��Һ��pH��a>b
C. ͼ����ʾ�����ܸı仯ѧ��Ӧ���ʱ�
D. ͼ����ʾ����NO2���ݻ���ͬ�ĺ����ܱ������У���ͬ�¶��·ֱ�����Ӧ��2NO2(g)![]() N2O4(g)����ͬʱ�����NO2���������ߣ���÷�Ӧ����H<0
N2O4(g)����ͬʱ�����NO2���������ߣ���÷�Ӧ����H<0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com