
【题目】为了配制 100 个水分子含有 1 个钠离子的溶液,90.9 g 水中需要投入钠的质量是
A. 4.6 g B. 2.3 g C. 1.161 5 g D. 1.15 g
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
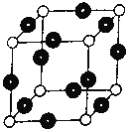
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
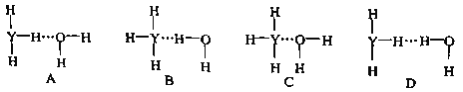
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸牛奶中的乳酸可增进食欲、促进胃液分泌、增强肠胃的消化功能,对人体具有保健作用,乳酸分子的结构简式为![]() 。工业上可由乙烯来合成乳酸,方法如下:
。工业上可由乙烯来合成乳酸,方法如下:

(1)乳酸所含的官能团的名称是_________________________。
(2)写出下列物质转化的化学方程式:
①A→B______________________________________。
②B→CH3CHO____________________________________。
③![]() __________________________________。
__________________________________。
(3)A在一定条件下可发生消去反应,写出其发生消去反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不能设计成原电池的是( )
A.2CH3OH+3O2→2CO2+4H2O
B.NaOH+HCl=NaCl+H2O
C.Zn+2HCl=ZnCl2+H2↑
D.4Al+3O2+6H2O=4Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应 B. 与NaOH水溶液共热
C. 在催化剂存在下与氢气作用 D. 与银氨溶液作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸(CH3—CH=CH—CH=CH—COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是( )
A.可与钠反应
B.可与碳酸钠溶液反应
C.可与溴水溶液发生取代反应
D.分子中含有两种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素,用化学用语回答以下问题。
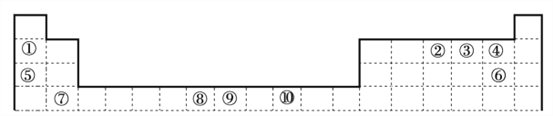
(1)其中属于过渡元素的是_____________,比较②的氢化物与同族第3、4周期元素所形成的氢化物沸点高低并说明理由_____________
(2)②与③中第一电离能较小的元素是_____________;①和④形成的物质与⑤和⑥形成的物质晶体中熔点较高的是_____________。
(3)①形成的有机试剂在有机合成中有重要应用,但极易与O2、CO2等反应。下列说法不正确的是_____________(填字母序号)
a.CO2中键σ与π键的数目之比为1:1
b.游离态和化合态①元素均可由特征发射光谱检出
c.叔丁基锂([(CH3)3C]Li)中碳原子的杂化轨道类型为sp3和sp2
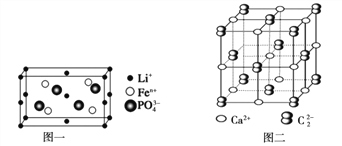
(4)如图一是上述元素形成的物质晶胞结构示意图,其化学式为_____________,其中Fen+的基态电子排布式为_____________,PO43-的空间构型为_____________
(5)金属①的晶体为体心立方晶胞,其配位数为_____________;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是_____________
(6)上述元素形成的CaC2晶体的晶胞结构与NaCl晶体的相似(如图二所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长(粒子间距增加)。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林的化学成分是乙酰水杨酸,在胃内分解成水杨酸。若服用阿司匹林过量时可出现头痛、眩晕、恶心、呕吐、耳鸣,甚至精神错乱等副作用,称之为水杨酸反应。若出现水杨酸反应,应该采取的措施是
A. 饮用大量清水 B. 洗胃 C. 减少用药量 D. 停药,静脉滴注NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,33.6L 氟化氢中含有氟原子的数目为 1.5NA
B. 常温常压下,7.0g 乙烯与丙烯的混合物中含有氢原子的数目为 NA
C. 50mL l8.4mol/L 浓硫酸与足量铜微热反应,生成 SO2 分子的数目为 0.46NA
D. 某密闭容器盛有 0.lmolN2 和 0.3molH2,在一定条件下充分反应,转移电子的数目为 0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com