
【题目】美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应 B. 与NaOH水溶液共热
C. 在催化剂存在下与氢气作用 D. 与银氨溶液作用
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现用该浓硫酸配制450 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有______________(写仪器名称);
(2)经计算,欲配制450 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为____mL,量取浓硫酸时应选用____规格的量筒;
A.10 mL B.50 mL C.100 mL D.200 mL
(3)在烧杯中稀释浓硫酸的实验操作为_____________________________。
(4)在配制过程中,若用量筒量取浓硫酸时,俯视刻度线,会使所配溶液浓度_________;若转移溶液时,不慎有少量溶液洒出,会使所配溶液浓度_________,若定容时,俯视容量瓶刻度线,会使所配溶液浓度_________(填“偏大、偏小、无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某市售盐酸试剂瓶上的部分数据:

(1)该市售盐酸的物质的量浓度为_________mol/L。(计算结果精确到小数点后1位,下同)
(2)欲配制1mol/L盐酸溶液475mL,则需量取该市售盐酸_____mL,除烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是________;下列情况会使所配溶液浓度偏高的是______(填序号)
A.量筒使用前用未干燥
B.用量筒量取浓盐酸时,俯视刻度线
C.量取出的浓盐酸露置较长时间后才加水稀释
D.洗涤量取浓盐酸的量筒,并将洗涤液转移到容量瓶中
(3)浓度均为1mol/L的盐酸与氢氧化钡溶液等体积混合后OH-的物质的量浓度=___________mol/L(忽略溶液体积变化);质量分数分别为36.5%和13.5%的盐酸等体积混合,所得溶液的质量分数__________25%(填“>”“<”或“=”);在标准状况下,1体积水吸收__________体积的HCl气体可制得36.5%的盐酸(水的密度以1.00g/cm3计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键( )
A.一定是共价键B.一定是离子键
C.可能是共价键,也可能是离子键D.上述说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列关于硝酸和硫酸的叙述中,错误的是( )
A.硫酸和硝酸都是重要的化工原料B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.稀硫酸和稀硝酸都具有氧化性D.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制 100 个水分子含有 1 个钠离子的溶液,90.9 g 水中需要投入钠的质量是
A. 4.6 g B. 2.3 g C. 1.161 5 g D. 1.15 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水 CuSO4 与熔化的钠接触, 瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是
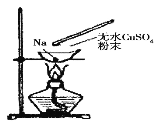
A. 上述反应是置换反应
B. 上述反应是放热反应
C. 上述反应中 CuSO4 表现了还原性
D. 加热且无水条件下,Na 可以与 CuSO4 反应并生成 Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 0.1L 无色溶液,其含有的阳离子可能是 K+、Cu2+、Ca2+,含有的阴离子可能 Cl-、CO32-、SO42-现做以下实验:
①取 50mL 溶液置于大烧杯中,向溶液中加入过量的 BaCl2 溶液振荡,有白色沉淀生成;过滤,洗涤, 干燥,后称得 4.30g 固体
②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过 滤洗涤干燥后称量得到 2.33g
③取少量①实验后上层清液滴入 AgNO3 溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原溶液中肯定不含有_____(填离子符号),一定含有__________________(填离子符号),可能含有_____(填离子符号),请设计方案证明原溶液中可能含 有的离子:_________。
(2)写出上述过程中一定发生反应的离子方程式:_________。
(3)若经证明没有 Cl—则该溶液中的 K+的物质的量浓度是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.2 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(l)如图所示的仪器中配制溶液一定不需要的是 ___(填字母序号),配制上述溶液还需用到的玻璃仪器是____填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算,用托盘天平称取NaOH固体____g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则配置的溶液浓度_____填“偏高”、“偏低”或“无影响”)。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为____mL(计算结果保留一位小数);
②如果实验室有15 mL、20 mL、50 mL量筒,应选用 ___mL量筒最好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com