
【题目】 下列关于硝酸和硫酸的叙述中,错误的是( )
A.硫酸和硝酸都是重要的化工原料B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.稀硫酸和稀硝酸都具有氧化性D.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×l0-3)制备FePO4流程如下:

(1)“溶解”时H3PO4不宜过量太多的原因是___。
(2)①写出“反应”时总反应的离子方程式:____。
②证明“反应”后铁元素沉淀完全的实验方法是___。
(3)①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是____。
②洗涤FePO4沉淀的操作是 ___。
(4)FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近l00℃时易失去结晶水。相关物质的溶解度曲线如图所示。
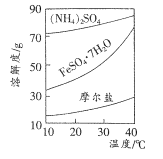
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入____。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如右图所示。下列说法错误的是
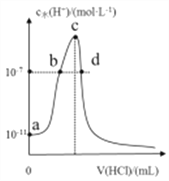
A. 常温下,0.1mol/L氨水的电离平衡常数Kb约为1.0×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)-)
D. c点溶质为NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子总数比A原子核外电子总数多5个电子,则A,B可形成的化合物为( )
A.A2B
B.AB2
C.B2A3
D.B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应 B. 与NaOH水溶液共热
C. 在催化剂存在下与氢气作用 D. 与银氨溶液作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是( )
A.节约用水用电B.利用风力发电
C.增加植被面积D.燃烧煤炭供热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156 --157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(l)对青蒿干燥破碎后,加入乙醚的目的是_________________。
(2)操作I需要的玻璃仪器主要有烧杯、 ___,操作Ⅱ的名称是___________。
(3)操作Ⅲ的主要过程可能是____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)在用分液漏斗进行分液操作时,为使液体顺利滴下,应进行的具体操作是____,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿 烧杯壁流下。分液后漏斗内剩余的液体从分液漏斗的 ___(填“上口”或 “下口”)倒入烧杯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com