
已知在酸性条件下能发生下列反应:Cu+→ Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol·L-1硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是二氧化硫 | D.反应中硫酸作氧化剂 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: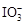 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: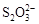 >I-;②KI+I2
>I-;②KI+I2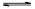 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有 (用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| | 0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol·L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol?L-1
②向另一份固体中加入100 mL 4.0 mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol?L-1则产生的气体的体积(标准状况)为 ( )
| A.2.856L | B.2.448L | C.2.688L | D.2.352L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验现象或分析结论中,正确的是
| A.二氧化硫通入品红试液中红色褪去,说明二氧化硫具有还原性 |
| B.利用金属与盐酸反应,可比较铝和镁的金属性强弱 |
| C.向鸡蛋清溶液中加入甲醛溶液,可使蛋白质的溶解度降低而析出 |
| D.制备乙酸乙酯的实验中,可用浓氢氧化钠溶液代替饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关元素化合物的叙述中正确的是
| A.钠在空气中燃烧生成白色的氧化钠固体 |
| B.检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 |
| C.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色 |
| D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学查阅资料得知制作皮蛋的料泥中含有NaOH和Na2CO3,将料泥溶解过滤后,向滤液中加入以下试剂,肯定不会出现的现象是
| A.酚酞—溶液变红 | B.石蕊—溶液变蓝 |
| C.甲基橙—溶液变黄 | D.滴加稀盐酸—立即产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
| A.0.24mol | B.0.21mol | C.0.25mol | D.0.12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
| A.元素Y、P的简单氢化物中化学键类型相同 |
| B.原子半径:X>Y |
| C.最高价氧化物的水化物酸性:P<Q |
| D.X、Q两元素的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述和判断均正确,且有因果关系的是( )
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com