
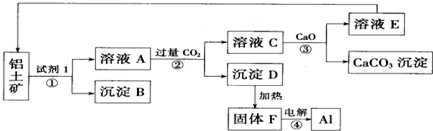
分析 铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液A中含氢氧化钠和偏铝酸钠;通入二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸钠,二氧化碳和氢氧化钠反应生成碳酸钠,过滤得到氢氧化铝沉淀和碳酸钠溶液;灼烧氢氧化铝得到氧化铝和水,电解氧化铝得到铝和氧气;碳酸钠溶液和氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠用来碱浸;灼烧碳酸钙得到氧化钙和二氧化碳,二氧化碳和氧化钙循环使用,以此解答该题.
解答 解:铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液A中含氢氧化钠和偏铝酸钠;通入二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸钠,二氧化碳和氢氧化钠反应生成碳酸钠,过滤得到氢氧化铝沉淀和碳酸钠溶液;灼烧氢氧化铝得到氧化铝和水,电解氧化铝得到铝和氧气;碳酸钠溶液和氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠用来碱浸;灼烧碳酸钙得到氧化钙和二氧化碳,二氧化碳和氧化钙循环使用,
(1)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;电解氧化铝需要破坏离子键,需要吸收大量的能量;
故答案为:NaOH;④;
(2)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀为氧化铁,
故答案为:Fe2O3;
(3)电解氧化铝的方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,设得到铝的质量为x,
2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ 转移电子
108g 12mol
x 6mol
解得x=54g;
故答案为:54;
(4)煅烧碳酸钙得到CaO和CO2,B生成沉淀需要二氧化碳、碳酸钠转化为碳酸钙需要CaO,所以CaO和CO2能循环利用,
故答案为:CaO和CO2;
(5)①铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO-2+H2O,
偏铝酸钠溶液通入过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
故答案为:Al2O3+2OH-=2 AlO 2 -+H2O;CO 2+AlO2 -+2H2O=Al(OH) 3↓+HCO 3 -;
(6)电解氧化铝生成铝和氧气,反应的方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题考查物质分离和提纯,侧重考查学生分析及知识运用能力,明确物质性质及基本操作方法、反应原理即可解答,知道常见元素化合物知识及常见离子检验方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠放置在空气中,最终转变为白色粉末Na2CO3 | |
| B. | Ca(ClO)2溶液通入CO2,溶液变浑浊;再加入品红溶液,红色褪去 | |
| C. | 打磨过的铝箔和未打磨的铝箔分别在空气中灼烧,两种铝箔均熔化但不滴落,说明氧化铝熔点比铝高 | |
| D. | 在一定条件下,金属Na、Mg、Fe与水反应都生成H2和对应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某有机物通入酸性高锰酸钾溶液中,溶液褪色,则该有机物一定是不饱和烃 | |
| B. | 向甲苯和乙醇中分别加入少量水,振荡后分层的是甲苯 | |
| C. | 向乙苯和苯中分别滴加溴水,溶液褪色的是乙苯 | |
| D. | 向溴乙烷和己烷中滴加硝酸银溶液,产生浅黄色沉淀的是溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
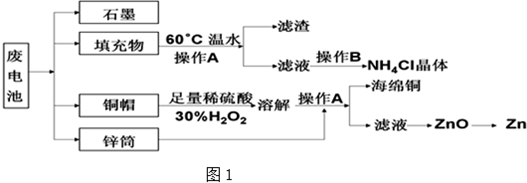
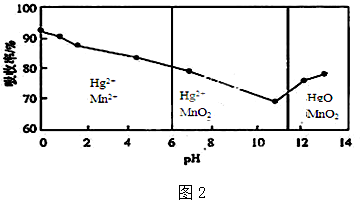
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
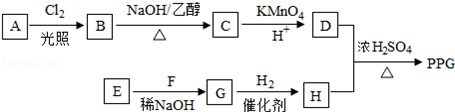
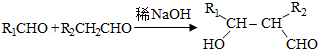
 .
.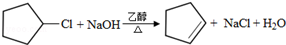 .
.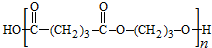 .
.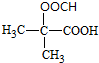 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com