
分析 H2S和O2的混合气体点燃,氧气不足发生反应①2H2S+O2═2S↓+2H2O,氧气足量发生反应②2H2S+3O2═2SO2+2H2O,据此讨论,若n(H2S):n(O2)>2:1,发生反应①,H2S有剩余;若n(H2S):n(O2)=2:1,发生反应①,没有气体;若n(H2S):n(O2)<2:3,发生反应②,氧气有剩余,气体为氧气、二氧化硫;若n(H2S):n(O2)=2:3,发生反应②,气体为二氧化硫;若2:3<n(H2S):n(O2)<2:1,发生反应①②,气体为二氧化硫,据此进行计算.
解答 解:H2S和O2的混合气体点燃,氧气不足发生反应①2H2S+O2═2S↓+2H2O,氧气足量发生反应②2H2S+3O2═2SO2+2H2O,
若n(H2S):n(O2)>2:1,发生反应①,H2S有剩余,则:
2 H2S+O2═2 S↓+2 H2O 体积变化△V;
2 1 3
50ml 25ml 100mL-25mL=75mL
剩余气体为25mLH2S,原混合气体中O2为25mL,H2S为:100mL-25mL=75mL,符合题意;
若n(H2S):n(O2)=2:1,发生反应①,没有剩余气体,不符合题意;
若n(H2S):n(O2)<2:3,发生反应②,氧气有剩余,则:
2 H2S+3 O2═2 SO2+2H2O 体积变化△V;
2 3 2 3
50mL 75mL 50mL 100mL-25mL=75mL
剩余气体为氧气、二氧化硫,其中二氧化硫为50mL,不符合题意;
若n(H2S):n(O2)=2:3,发生反应②,最后气体为二氧化硫,体积为50mL,不符合题意;
若2:3<n(H2S):n(O2)<2:1,发生反应①②,气体为二氧化硫,则:
2 H2S+3 O2═2 SO2+2H2O
25mL 37.5mL 25mL
发生反应①的气体体积为:100mL-25mL-37.5mL=37.5mL,其中消耗硫化氢的体积为:37.5mL×$\frac{2}{3}$=25mL,反应消耗氧气的体积为:37.5mL×$\frac{1}{3}$=12.5mL,
所以原混合气体中硫化氢的总体积为:25mL+25mL=50mL,氧气的总体积为:37.5mL+12.5mL=50mL,
答:剩余气体为H2S,原混合气体中可能含有O225mL、H2S75mL;剩余气体为二氧化硫,则H2S为50mL氧气、50mL硫化氢.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意讨论法、差量法在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1•min-1 | B. | 0.4mol•L-1•min-1 | ||
| C. | 0.1mol•L-1•min-1 | D. | 0.2mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1食盐溶液 | B. | 0.5mol•L-1NaHSO4溶液 | ||
| C. | 0.5mol•L-1氯化钾溶液 | D. | 蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
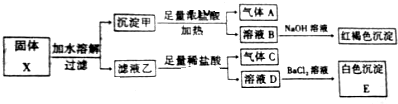
| A. | 固体X中一定含有Fe2O3 | B. | 沉淀E可能含有BaSO3 | ||
| C. | 气体A、C一定均为纯净物 | D. | 固体X可能出现含有K2SO3、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)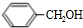 ;C中含有的官能团碳碳双键和醛基(写名称).
;C中含有的官能团碳碳双键和醛基(写名称). .
. .
.


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
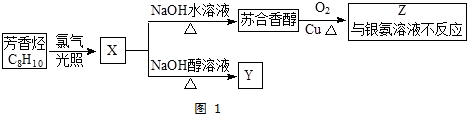
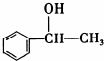 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.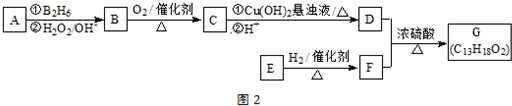
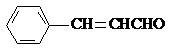 .
.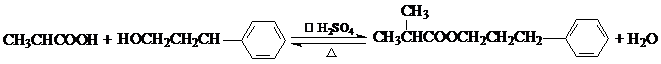 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | ③④⑤⑦⑨ | C. | ①③⑤⑦⑨ | D. | ①③④⑦⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com