
【题目】X,Y,Z,M,N,Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( ) 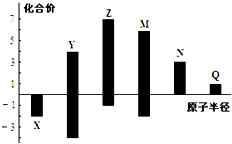
A.金属性:N>Q
B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X
D.原子序数:Z>M>Y>X
【答案】B
【解析】解:X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为﹣2价,没有正化合价,故X为O元素,M的化合价为+6、﹣2价,故M为S元素;Z的最高正价为+7价、最低价﹣1,则Z为Cl元素;Y的化合价为+4、﹣4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素.
A.同周期自左而右金属性减弱,故金属性Na>Al,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性高氯酸>硫酸>偏铝酸,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2﹣>Na+>Al3+ , 故C错误;
D.原子序数:Z(Cl)>M(S)>X(O)>Y(C),故D错误,
故选B.
X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为﹣2价,没有正化合价,故X为O元素,M的化合价为+6、﹣2价,故M为S元素;Z的最高正价为+7价、最低价﹣1,则Z为Cl元素;Y的化合价为+4、﹣4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素,据此解答.


科目:高中化学 来源: 题型:
【题目】H2O2被称为绿色氧化剂,受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请问答下列问题:
(1)定性分析:图甲可通过观察____________,定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看________,实验中需要测量的数据是_______。

(3)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和草酸反应的离子方程式为________,反应开始一段时间后反应速率明显提升的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系.已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;D和E的反应是化工生产中的一种重要的固氮反应. 
请回答下列问题:
①E 和J的电子式分别是和 .
②写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况
③将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为 .
④标况下3.36L气体B与A完全反应,转移电子的数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.0.1 mol·L-1的Na2CO3溶液中各离子浓度的关系
(1)大小关系:______________________________________________;
(2)物料守恒:______________________________________________;
(3)电荷守恒:______________________________________________;
(4)质子守恒:______________________________________________。
II.比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为:___________。
(2)pH=2的CH3COOH与pH=12的NaOH等体积混合,其离子浓度大小顺序为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学变化中,原子的原子核不发生变化,核外电子可能会发生变化
B.同一主族中,相邻周期元素原子的核电荷数相差8、18或者32
C.目前第七周期元素已经排满,该周期一共有32种元素
D.同主族元素,从上往下非金属性减弱,相应最高价含氧酸的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1﹣20号元素A、B、C、D所对应的物质的性质或微粒结构如下:
①A的原子M层上有6个电子;
②B2+与D﹣具有相同的电子层结构,且可以相互组合形成常见干燥剂;
③元素C的单质常温为双原子气体分子,其氢化物水溶液呈碱性;
④元素D的最高正化合价为+7价.请回答下列问题:
(1)B的离子与D的离子相互组合形成的干燥剂的化学式是 .
(2)元素C与氢元素形成带一个单位正电荷的离子,为10电子微粒,写出该微粒的电子式(用元素符号表示) .
(3)元素A与元素D相比,非金属性较强的是(用元素符号表示),下列表述中能
证明这一事实的是 .
a.常温下A的单质和D的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D单质能从A的氢化物水溶液中置换出A单质
d.HD的酸性比HA酸性强.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】产自我国西北某盐湖的“块碱”是一种Na2CO3和NaCl的混合物。可通过以下方法对块碱样品的组成和含量进行分析测定。
Ⅰ.定性测定NaCl的存在:
(1)取样品少许溶于水,加入足量稀硝酸充分反应后再滴加____________溶液,能观察到有___________产生,说明块碱中含有NaCl。
Ⅱ.定量测定Na2CO3的含量:
准确称量w g样品置于如下装置中,向其中加入足量稀硫酸,通过测定生成气体的体积来求算Na2CO3的含量。请回答下列相关问题:

(2)测定装置中,导管a的作用是_____________________。
(3)为提高测定的准确度,溶液b最宜选用__________________。
①饱和食盐水
②饱和NaHCO3溶液
③澄清石灰水
④酸性KMnO4溶液
(4)若根据所取样品的质量估计反应时产生的气体体积最多在30mL左右,则产生气体前对量气装置读数时,装置内的装液量和液面调节最为合理的是_____________(填虚线框中对应这的字母编号)。
(5)用你以上所选出的最为合理的读数为起点,若终点读数为17.60mL,则反应所产生的气体的测定体积为_________mL。若实验温度下的气体摩尔体积为VmL.mol-1,由此可得出样品中Na2CO3的含量表达式为:Na2CO3%=___________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com