
【题目】I.0.1 mol·L-1的Na2CO3溶液中各离子浓度的关系
(1)大小关系:______________________________________________;
(2)物料守恒:______________________________________________;
(3)电荷守恒:______________________________________________;
(4)质子守恒:______________________________________________。
II.比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为:___________。
(2)pH=2的CH3COOH与pH=12的NaOH等体积混合,其离子浓度大小顺序为:________________。
【答案】 c(Na+)>c(CO![]() )>c(OH-)>c(HCO)>c(H+) c(Na+)=2[c(CO
)>c(OH-)>c(HCO)>c(H+) c(Na+)=2[c(CO![]() )+c(HCO)+c(H2CO3)] c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO
)+c(HCO)+c(H2CO3)] c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO![]() ) c(OH-)=c(H+)+2c(H2CO3)+c(HCO) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
) c(OH-)=c(H+)+2c(H2CO3)+c(HCO) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】I.(1)碳酸钠溶液中存在Na2CO3![]() CO32-+2Na+,CO32-+H2O
CO32-+2Na+,CO32-+H2O![]() OH-+HCO、HCO+H2O
OH-+HCO、HCO+H2O![]() H2CO3+OH-,以及H2O
H2CO3+OH-,以及H2O ![]() H++OH-,碳酸根离子的第一步的水解程度大于第二步,因此c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+);
H++OH-,碳酸根离子的第一步的水解程度大于第二步,因此c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+);
(2)碳酸钠溶液中存在物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故答案为:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
(3)碳酸钠溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO32-),故答案为:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO32-);
(4)碳酸钠溶液中的质子守恒,可以用物料守恒互溶电荷守恒处理得到c(OH-)=c(H+)+2c(H2CO3)+c(HCO),故答案为:c(OH-)=c(H+)+2c(H2CO3)+c(HCO);
II.(1)将等体积等浓度的CH3COOH和NaOH溶液混合,反应后溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可得:c(Na+)>c(CH3COO-),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)醋酸为弱电解质,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可得:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤維
D. NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是( )
A.制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
B.制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,M,N,Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( ) 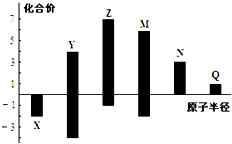
A.金属性:N>Q
B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X
D.原子序数:Z>M>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸甲酯A(C10H10O2)是一种用于辅助胃肠道痉挛及溃疡的药物,其合成路线如下图所示:
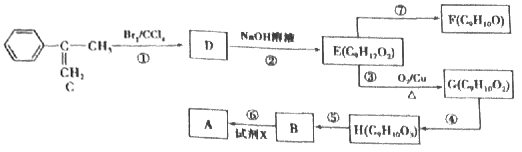
请回答下列问题:
(1)试剂X是甲醇,则B的名称是_____,B中含有的官能团的名称为_______。
(2)写出反应②的化学方程式:____________。
(3)C的分子式为_____,写出C的最简单同系物的名称______。G的结构简式为___________。
(4)A的同分异构体中,能使溴的四氯化碳溶液褪色、能水解、能发生银镜反应、含有苯环且只有一个取代基的同分异构体有______种。写出其中核磁共振氢谱吸收峰最多的一种______(写结构简式)。
(5)写出以甲基丙烯(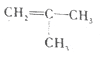 )为原料制备甲基丙烯酸(
)为原料制备甲基丙烯酸(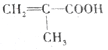 )路线图(无机试剂任选):_____________。
)路线图(无机试剂任选):_____________。
合成反应流程图表示方法示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜膜的材质有聚乙烯、聚氯乙烯等种类。下列叙述错误的是
A.等质量的聚乙烯和乙烯完全燃烧消耗氧气的量相等
B.聚氯乙烯薄膜放入试管中加强热可产生酸性气体,故不宜装熟食
C.聚氯乙烯的单体可由聚乙烯的单体与氯化氢加成制得
D.废弃的聚乙烯和聚氯乙烯均可回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图:

请回答下列问题:
(1)图中甲池是__________(填“原电池”、“原解池”、“原镀池”),乙池中A电极的名称是__________(填“正极”、“负极”、“阴极”或“阳极”)
(2)写出甲池中甲醇发生反应的电极反应式:______________________________________________
(3)当乙池中B极质量增加10.8克,理论上甲池中消耗O2的体积为:_______L(标准状况),此时丙池中D极析出3.2g某金属,则丙池中的某盐溶液可能是__________(填字母,下同)
a.MgSO4溶液b.CuSO4溶液c.NaCl溶液d.AgNO3溶液
(4)若丙中电极不变,将其溶液换成NaCl溶液,一段时间后,丙中溶液的pH将_________(填“增大”、“减小”或“不变”);甲中溶液的pH将_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com