
【题目】元素X的原子最外层电子排布式为nsnnpn+1。试解答下列各题:
(1)电子排布式中的n=________;原子中能量最高的是________电子,其电子云在空间有______________________方向,原子轨道呈现________形。
(2)元素X的名称是________;它的氢化物的电子式是________。
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有着广泛的应用。回答下列问题:
(1)基态K原子中,核外电子的空间运动状态共____种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K____(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为_____,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为_________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图所示。
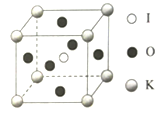
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为_______nm,与K紧邻的O的个数为______。阿伏加德罗常数的值为6.02×1023,列式计算晶体的密度为_________g/cm3.(不必计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1KOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。下列说法正确的是( )

A. a点所得溶液中:2c(H2A)+c(A2-)=0.1mol/L
B. b点所得溶液中:2c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c点所得溶液中:c(K+)<3c(HA-)
D. d点所得溶液中A2-第一级水解平衡常数为10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 所有铵盐受热均可以分解,产物均有NH3
B. 检验铵盐中含有NH的操作是取少量某盐放入试管中,加入稀氢氧化钠溶液,用湿润的红色石蕊试纸放在试管口
C. NH4Cl溶液中加入NaOH溶液共热时,反应的离子方程式为NH+OH-![]() NH3↑+H2O
NH3↑+H2O
D. NH4Cl和NaCl的固体混合物可用升华法分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设某元素的原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A. 不能由此确定该元素的相对原子质量
B. 这种元素的相对原子质量为(m+n)g
C. 碳原子质量为wg,此原子的质量为(m+n)wg
D. 核内中子的总质量小于质子的总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是
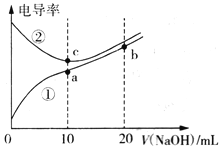
A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学物质及其变化的科学方法之一,下列分类合理的是
A. Na2CO3和NaHCO3都属于盐类
B. NaOH和Na2O都属于碱
C. 白银、黄铜、臭氧都属于单质
D. 蔗糖、硫酸、氯化镁都属于电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com