
【题目】钾和碘的相关化合物在化工医药材料等领域有着广泛的应用。回答下列问题:
(1)基态K原子中,核外电子的空间运动状态共____种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K____(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为_____,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为_________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图所示。
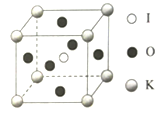
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为_______nm,与K紧邻的O的个数为______。阿伏加德罗常数的值为6.02×1023,列式计算晶体的密度为_________g/cm3.(不必计算结果)
【答案】 10 球形 < < 三角锥形 sp3杂化 HIO4中I的正电性更高,导致I-O-H中O的电子向I偏移,更容易电离出H+,酸性更强 ![]() nm 或0.386 nm 12
nm 或0.386 nm 12 ![]()
【解析】(1)基态K原子的电子排布为1s22s22p63s23p64s1,所以核外电子的空间运动状态共10种,核外电子占据的最高能层为N;K原子最外层4s轨道电子云轮廓为球形;
(2)由于K原子的半径比较大而且价电子数较少,第一电离能比较:K<Cr,金属键强度比较:K<Cr。
(3)I3+的中心碘原子的价层电子对数为![]() ,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形型;中心原子采用sp3杂化杂化。
,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形型;中心原子采用sp3杂化杂化。
(4)HIO4中I的正电性更高,导致I-O-H中O的电子向I偏移,更容易电离出H+,酸性更强,所以HIO4的酸性强于HIO3,
(5)由晶胞图可知,K原子处于顶角,I原子处于体心,两者的最近距离为立方体体对角线的一半,即![]() nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子;由晶胞图可知,每个晶胞实际拥有:K原子:1个(8个顶点),I原子1个(体心),O原子3个(6个面心),化学式为KIO3,一个晶胞的质量为:
nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子;由晶胞图可知,每个晶胞实际拥有:K原子:1个(8个顶点),I原子1个(体心),O原子3个(6个面心),化学式为KIO3,一个晶胞的质量为:![]() g,一个晶胞的体积为(0.446×10-7)3cm3,根据
g,一个晶胞的体积为(0.446×10-7)3cm3,根据![]() ,得晶体的密度为
,得晶体的密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
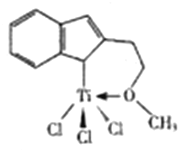
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
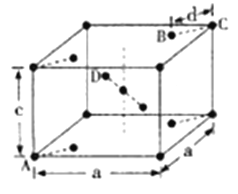
①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是
X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是

A. Z和W在该条件下有一种可能为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等。
C. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A. X的氢化物溶于水显酸性 B. Y原子的电子排布式为1s22s22p63s2
C. Z元素在周期表中的位置为第三周期第Ⅵ族 D. X和Z的最高价氧化物对应水化物都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10.6g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3物质的量_______。
(2)Na2CO3溶液的物质的量浓度_______。
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.4mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子最外层电子排布式为nsnnpn+1。试解答下列各题:
(1)电子排布式中的n=________;原子中能量最高的是________电子,其电子云在空间有______________________方向,原子轨道呈现________形。
(2)元素X的名称是________;它的氢化物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中富含碘元素.从海带中提取碘有如下步骤:( )
①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com