
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
【答案】B
【解析】试题分析:A、H2A是弱电解质,H2A在水中的电离方程式是:H2AH++HA-、HA-H++A2-,故A错误;B、当V(NaOH)="20" mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;C、由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,故C错误;D、当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA-)+3c(H2A)═c(A2-)+2c(OH-),故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】NaBiO3可作为测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备,工艺流程如下:
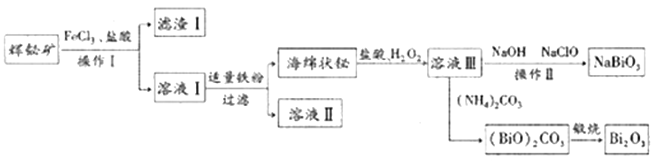
已知:NaBiO3难溶于水。
回答下列问题
(1)溶液Ⅰ中主要成分为BiCl3、FeCl2,则滤渣Ⅰ的主要成分是________(写化学式)。
(2)海绵铋与盐酸、H2O2反应的化学方程式是__________
(3)向溶液Ⅲ中加入NaOH和NaClO发生反应的离于方程式是______,从反应后的混合体系中获得纯净NaBiO3,操作Ⅱ包括_________。
(4)一定温度下,向氨水中通入CO2,得到 (NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将______(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=______(用离子浓度表示)。

(5)取所得NaBiO3样品2.0g,加入稀硫酸和MnSO4溶液使其完全溶解,然后用新配制的0.5mol/LFeSO4溶液滴定生成的MnO4-,滴定完成后消耗22.00mLFeSO4溶液。则该样晶中NaBiO3纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既作氧化剂又作还原剂的是( )
A. 2F2+2H2O===4HF+O2 B. 2Na+2H2O===2NaOH+H2↑
C. CaO+H2O===Ca(OH)2 D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的且符合操作要求的是
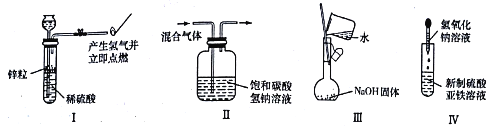
A. I可用于制备并检验氢气的可燃性
B. II可用于除去CO2中的HCl
C. 用Ⅲ来配制一定物质的量浓度的NaOH溶液
D. 用IV中操作制备氢氧化亚铁并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂的含镍催化剂主要含有镍、铝、铁单质及它们的氧化物,还有部分不溶于酸和碱的杂质。为了从含镍催化剂中回收镍,设计了如下的工艺流程:
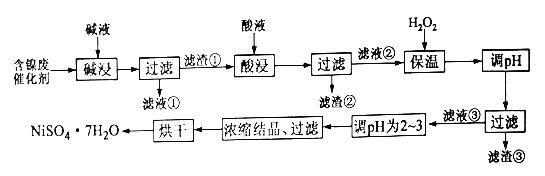
部分阳离子完全沉淀时溶液的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答如下问题:
(1)碱浸的目的是为了除去____________
(2)某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作_________
(3)加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为______,加入H2O2发生反应的离子方程式为___________。加入H2O2保温后调pH,下列范围合理的是______(填选项序号)。
A.1.8~3.2 B.2.0~3.0 C.3.3~5.2 D.9.2~9.7
(4)滤渣③的主要成分为_______,滤液③调pH为2~3的目的为________
(5)为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有着广泛的应用。回答下列问题:
(1)基态K原子中,核外电子的空间运动状态共____种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K____(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为_____,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为_________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图所示。
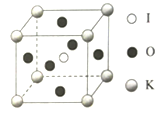
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为_______nm,与K紧邻的O的个数为______。阿伏加德罗常数的值为6.02×1023,列式计算晶体的密度为_________g/cm3.(不必计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 所有铵盐受热均可以分解,产物均有NH3
B. 检验铵盐中含有NH的操作是取少量某盐放入试管中,加入稀氢氧化钠溶液,用湿润的红色石蕊试纸放在试管口
C. NH4Cl溶液中加入NaOH溶液共热时,反应的离子方程式为NH+OH-![]() NH3↑+H2O
NH3↑+H2O
D. NH4Cl和NaCl的固体混合物可用升华法分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com