
����Ŀ��ij�������ĺ���������Ҫ�����������������ʼ����ǵ���������в��ֲ�������ͼ�����ʡ�Ϊ�˴Ӻ��������л���������������µĹ�������:
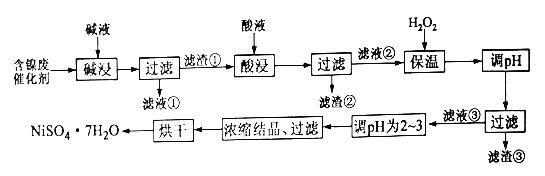
������������ȫ����ʱ��Һ��pH����:
������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
�ش���������:
(1)�����Ŀ����Ϊ�˳�ȥ____________
(2)ijѧϰС����ʵ������ģ����������,����ϴ�������ٵIJ���_________
(3)����H2O2������һ��ʱ������У����µ��¶Ȳ��˹��ߵ�ԭ��Ϊ______,����H2O2������Ӧ�����ӷ���ʽΪ___________������H2O2���º��pH,���з�Χ��������______(��ѡ�����)��
A.1.8~3.2 B.2.0~3.0 C.3.3~5.2 D.9.2~9.7
(4)�����۵���Ҫ�ɷ�Ϊ_______,��Һ�۵�pHΪ2~3��Ŀ��Ϊ________
(5)Ϊ�ⶨ��Ʒ��NiSO4��7H2O���ȣ�ijͬѧ��һ��������Ʒ����ˮ,�������м���������BaCl2��Һ,���ˡ�ϴ�ӳ���������,����������ͨ�����㷢�ֲ�Ʒ��NiSO4��7H2O��������������100%,����ܵ�ԭ��Ϊ____________________
���𰸡� Al��Al2O3 ��©���м���������ˮ��û�����٣���ˮ��Ȼ���º��ظ���������2��3�� �¶ȸߣ���ʹH2O2���ٷֽ⣬����ԭ�������� H2O2 + 2Fe2+ + 2H+ == 2Fe3+ + 2H2O C Fe(OH)3 ��Ũ���ᾧ�����з�ֹNi2+ˮ�� ���ʱʧȥ�˲��ֽᾧˮ
�����������������������Ϊ�˳�ȥ�����������K����֬,��������Ԫ�غ�ǿ�Ӧ,�������������������ǿ�Ӧ,�����ʺ������������ﲻ�ͼӦ�ﵽ��ȥ��Ԫ�ص�Ŀ��;��Ӧ�����ַ���ʽΪ:2Al+2OH-+2H2O=2AlO2-+3H2����Al2O3+2OH-=2AlO2-+3H2O����ˣ�������ȷ����:Al��Al2O3����֬��
(2)ϴ�������ٵIJ�������©���м���������ˮ��û�����٣���ˮ��Ȼ���º��ظ���������2��3�Σ�
��3������H2O2������һ��ʱ������У����µ��¶Ȳ��˹��ߵ�ԭ��Ϊ�¶ȸߣ���ʹH2O2���ٷֽ⣬����ԭ�������ʣ�����H2O2������������Fe2+����Fe3+�����ݵ����غ��ԭ���غ㣬������Ӧ�����ӷ���ʽΪH2O2 + 2Fe2+ + 2H+ == 2Fe3+ + 2H2O������H2O2���º��pH������Χ��3.3![]() 5.2��ȷ��Fe3+������ȫ��
5.2��ȷ��Fe3+������ȫ��
(4)������ͼ֪�������۵���Ҫ�ɷ�ΪFe(OH)3 ,��Һ�۵�pHΪ2![]() 3��Ŀ��Ϊ��Ũ���ᾧ�����з�ֹNi2+ˮ�⣻
3��Ŀ��Ϊ��Ũ���ᾧ�����з�ֹNi2+ˮ�⣻
(5)�ֲ�Ʒ��NiSO4��7H2O��������������100������ԭ������Ǻ��ʱʧȥ�˲��ֽᾧˮ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:2CH3COCH3(1)![]() CH3COCH2COH(CH3)2(1)��ȡ����CH3COCH�ֱ���0����20���·�Ӧ,�����ת����(��)��ʱ��(t)�仯�Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����
CH3COCH2COH(CH3)2(1)��ȡ����CH3COCH�ֱ���0����20���·�Ӧ,�����ת����(��)��ʱ��(t)�仯�Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����
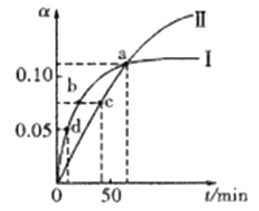
A. ��������ʾ20��ʱ��ת����Ӧ
B. �����¶�����߷�Ӧ���ƽ��ת����
C. ��a��ʱ,������������ʾ��Ӧ�Ļ�ѧƽ�ⳣ�����
D. ��ѧ��Ӧ���ʵĴ�С˳��Ϊ:d>b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѽ��仯�����ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á�
(1)��̬��ԭ�ӵļ۵����Ų�ʽΪ_____________������ͬ���ڵ�Ԫ���У���̬ԭ�ӵ�δ�ɶԵ�����������ͬ����____________�֡�
(2)�ѱȸ��ᡢ����Ӳ����һ�����˵Ľṹ���ϣ��ѵ�Ӳ�ȱ������ԭ����_________��
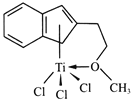
(3)��Ũ��TiCl3��������Һ�м������ѣ���ͨ��HCl�����ͣ��ɵõ���λ��Ϊ6�����ΪTiCl3��6H2O����ɫ���壬�þ�����������������ʵ���֮��Ϊ1��5�����������ӵĻ�ѧʽΪ___________��
(4)����Ľṹ����M�ܴ���ϩ����ϩ������ϩ�ľۺϣ���ṹ����ͼ��ʾ��
�����M��Ԫ���У��縺��������_________(������)��
��M��̼ԭ�ӵ��ӻ���ʽΪ____________��
��M���________(�����)��
a���м� b���Ҽ� c�����Ӽ� d����λ��
(5)���ʯ(TiO2)�Ǻ��ѵ���Ҫ����֮һ���侧���ṹ(��������ͬλ�õ�ԭ����ͬ)��ͼ��ʾ��
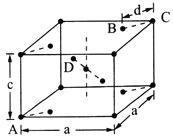
��A��B��C��D 4������������ԭ����________(�����)��
����A��B��C��ԭ������ֱ�ΪA(0��0��0)��B(0.69a��0.69a��c)��C(a��a��c)����D��ԭ������ΪD(0.19a��____��___)���������ļ���d=______(�ô���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Ʒ�к�������������������ijͬѧҪ�ⶨ������Ԫ�ص��������������������ʵ�鷽����

(1)��������������Һʱ�����õ��IJ����������ձ�����Ͳ������������ͷ�ι����⣬��������__________(����������)��
(2)��Ӧ���м�������H2O2��Һ����Ӧ�����ӷ���ʽ��_______________________________��
(3)���������![]() �Ƿ�ϴ�Ӹɾ��IJ�����_______________________________________��
�Ƿ�ϴ�Ӹɾ��IJ�����_______________________________________��
(4)���������ȣ���ȴ�����£�����ƽ������������Ⱥ�����������Ϊb1g���ٴμ��Ȳ���ȴ�����³�������Ϊb2g����b1��b2��0.3����Ӧ���еIJ�����_____________________��
(5)����������Ϊ42.6 g��������������Ⱥ�Ĺ����������Ϊ45.8 g������Ʒ����Ԫ�ص���������Ϊ________________��
(6)��ͬѧ��Ϊ����������ʵ�鲽��̫����������Ϊ��ֻҪ����Ʒ����ˮ��ֽ��裬���ȡ����ɡ����ճ������ɲ����Ʒ����Ԫ�ص���������������Ϊ������������Ƿ���У�__________(����С������С�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol/LNaOH��Һ�ֱ�μӵ�0.1mol/LHA��Һ��HB��Һ��,�������Һ������Ũ����pH�ı仯��ϵ��ͼ��ʾ������˵������ȷ����
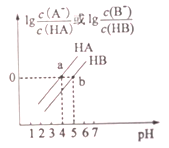
A. Ka(HB)<Ka(HA)
B. a��ʱ,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)
C. ������,0.1mol/LNaA��Һ��pH����0.1mol/LNaB��Һ��pH
D. ��HB��Һ�м���NaOH��Һ,�����Һ��c(B-)/c(HB)=10[pH-pKa(HB)](��֪:pKa=-lgKa)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0��2 mol/L H2A��Һ�еμ�0��2 mol/L NaOH��Һ���й��������ʵ����仯����ͼ(����������H2A��������HA����������A2��)������ͼʾ�жϣ�����˵����ȷ����

A. H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A===H����HA����HA��![]() H����A2��
H����A2��
B. ��V(NaOH)��20 mLʱ����Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(Na��)>c(HA��)>c(H��)>c(A2��)>c(OH��)
C. �������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
D. ��V(NaOH)��30 mLʱ����Һ�д������¹�ϵ��2c(H��)��c(HA��)��2c(H2A)��c(A2��)��2c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��5���л���ѧ����]����ȩ��������İٺ���ζ����Ƥ���Ĵ̼���С���Լ��ȶ����㷺���ڰٺϡ����㡢�������軨�Լ������������������������㾫�ĺϳɡ�������������ϴ�Ӽ������ϣ��������������ͻ�ױƷ�����ϡ���ϳ�·������ͼ��ʾ��

��1��B�й����ŵ������� ��
��2�����ķ�Ӧ������ ��
��3��д����Ӧ���Ļ�ѧ����ʽ ��
��4��������Ʒ�Ľṹʽ��ͼ��ʾ�������ȡ������ �֣�

����ȩ��ˮ��Һ�백ˮ����������Ƶ�������Ʒ���÷�Ӧ�Ļ�ѧ����ʽ ��
��5��д����������������A��ͬ���칹��
����������ȡ������ ����ȡ��������λ��
��6����֪��![]() �������������̣�д����CH3CH2CHOΪԭ���Ʊ�������
�������������̣�д����CH3CH2CHOΪԭ���Ʊ������� �ĺϳ�·������ͼ�����Լ�������ѡ����
�ĺϳ�·������ͼ�����Լ�������ѡ����
CH3CH2CHO�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷��Ѵ���Ϊԭ��ұ����������һ�ֹ�����ϣ���Ҫ�ɷ����±���
���� | TiO2 | MgO | SiO2 | CaO | Al2O3 |
�����ٷֺ���/% | 51.00 | 12.52 | 5.39 | 4.00 | 19.34 |
ͨ�����й������̿���ʵ��Ԫ��Ti��Al�� Si�Ļ������ã����õ����������Ѻͷ���ɸ��

��ش��������⣺
(1)����٢ڢ��н��з��������������_____________________��
(2)���й�����ϵijɷ��У������ڼ������������___________________(����ĸ���)��
a.TiO2 b.MgO c.SiO2 d.CaO
(3)�����¶Ⱥ��ѵ���ȡ�ʹ�ϵ����ͼ�������¶�Ϊ500�棬����__________________��

(4)��Һ�������ʵijɷ���_______________________��
(5)������з�����Ӧ�����ӷ���ʽ��___________________________��
(6)�����������ȡ����ɸ�Ļ�ѧ����ʽ����������_______
��____+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2��2H2O+��
���ݳɷֱ������ݣ�����10kg������ϣ�������Ӧ�ټ���Na2SiO3���ʵ����ļ���ʽ��n(Na2SiO3)=______mol (Ħ������/g/mol��SiO2 60 Al2O3 102)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ���ܴ���������ǣ�������
A.K+��HCO3����CO32����Br��
B.SO32����HSO3����OH����K+
C.Fe3+��Cu2+��NO3����SO32��
D.H+��Na+��NO3����Fe2+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com