
����Ŀ�������ܱ������������淴Ӧ��Z������+W������![]() X��g��+Y����������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬���ٸı������������й�˵������ȷ����
X��g��+Y����������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬���ٸı������������й�˵������ȷ����

A. Z��W�ڸ���������һ�ֿ���Ϊ��̬
B. t1~t2ʱ�����t3ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ��������������ȡ�
C. ���÷�Ӧֻ��ij�¶�T0�����Է����У���÷�Ӧ��ƽ�ⳣ��K���¶����߶�����
D. ���ڸ��¶��´˷�Ӧƽ�ⳣ������ʽΪK=c��X������t1~t2ʱ�����t3ʱ�̺��XŨ�Ȳ����
���𰸡�C
������������ͼ���֪������Ӧ���ʲ��淴Ӧʱ���ѹǿ�ĸı���ı�������Z��W���������壬A���������ͼ���֪��X�����壬Y���ܲ���������������壬��Ӧ�����������Ħ������ʼ�ղ������ͬ������t1~t2ʱ�����t3ʱ�̺�ʱ��η�Ӧ��ϵ�������ƽ��Ħ�������������Ҳ���ܲ��ȣ�B��������Ϊ�÷�Ӧֻ��ij�¶�T0�����Է����У�����H-TS<0���ó��÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�����ƣ�ƽ�ⳣ��K������C��ȷ��ƽ�ⳣ��ֻ���¶��й������¶��ºⳣ������ʽΪK=c��X���Ƕ�ֵ������t1~t2ʱ�����t3ʱ�̺��XŨ����ȣ�D��������ȷѡ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z���ֶ�����Ԫ����Ԫ�����ڱ��е����λ����ͼ��ʾ��������Ԫ�ص�ԭ������������֮��Ϊ24������˵���������

A. ���������ӵĻ�ԭ��Yǿ��X
B. W����̬�⻯��������ۺ����ᷴӦ�������ӻ�����
C. X��Y��Z����⻯�����ȶ�����������Y
D. ��Ԫ�����ڱ���118��Ԫ����Zλ��ͬһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯��������������������������ء�
(1)������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���塣
��֪��CO(g)+NO2(g)=NO(g)+CO2(g) ��H=-a kJ��mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ��H=-b kJ��mol-1(b>0)
����CO��ԭNO2��N2�������ı�״����3.36L COʱ���ų�������Ϊ___________kJ(�ú���a��b�Ĵ���ʽ��ʾ)��
(2)��373Kʱ�������Ϊ2L�ĺ������������ͨ��0.40 mol NO2��������Ӧ��2NO2(g)![]() N2O4(g) ��H=-57.0 kJ��mol-1�����NO2���������[
N2O4(g) ��H=-57.0 kJ��mol-1�����NO2���������[![]() (NO2)]�뷴Ӧʱ��(t)�Ĺ�ϵ���±���
(NO2)]�뷴Ӧʱ��(t)�Ĺ�ϵ���±���

��0��20 min�ڣ�v(N2O4)=________mol��L-1��min-1��
��������Ӧ�У�v(NO2)=k1��c2(NO2)��v(N2O4)=k2��c(N2O4)������k1��k2Ϊ���ʳ�������373Kʱ��k1��k2����ѧ��ϵʽΪ_____________���ı��¶���T1ʱk1=k2����T1_________373K(�>������<����=��)��
(3)����������(H2N2O2)��һ�ֶ�Ԫ���ᡣ25��ʱ����100 mL 0.1 mol��L-1H2N2O2��Һ�м���V mL 0.1mol��L-1 NaOH��Һ��(��֪25��ʱ�������������Ka1=10-7��Ka2=10-12)
����V=100����������Һ��c(H2N2O2)_____________c(N2O22-) (�>������<����=��)��ͨ���������ԭ��____________________________________________________________��
����V=200����������Һ������Ũ���ɴ�С��˳��Ϊ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧFulvio Cacace���˻���˼��������о������N4���ӣ�N4���ӽṹ����ͼ��ʾ(�����P4����)����֪����1 mol N��N������167 kJ���������� 1 mol N��N���ų� 942 kJ �������ɴ��ж�����˵����ȷ����(����)
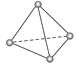
A. N4����һ�����͵Ļ����� B. N4��N2��Ϊͬ���칹��
C. N4�е��P4(����)�� D. 1 mol N4����ת��ΪN2���ų�882 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽʵ��Ŀ���ҷ��ϲ���Ҫ�����
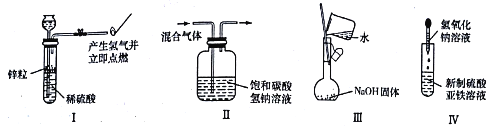
A. I�������Ʊ������������Ŀ�ȼ��
B. II�����ڳ�ȥCO2�е�HCl
C. ����������һ�����ʵ���Ũ�ȵ�NaOH��Һ
D. ��IV�в����Ʊ��������������۲�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ӫ����ķ���ԭ�������ù�����������ij������������������ݸ�ӫ�����ʷ���ӫ�⡣�ò�������Ľṹ��ʽ����ͼ��ʾ�������йظò��������˵������ȷ����
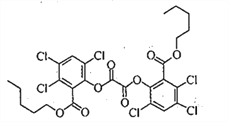
A. �����к���һ�ֺ���������
B. �����ϵ�һ�����ֻ��һ��
C. ���Է���ȡ����Ӧ�ͼӳɷ�Ӧ
D. lmol���������NaOH��Һ��Ӧ�������4mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���غ͵����ػ������ڻ���ҽҩ���ϵ��������Ź㷺��Ӧ�á��ش���������:
(1)��̬Kԭ���У�������ӵĿռ��˶�״̬��____�֣�ռ������ܼ��ĵ��ӵĵ���������ͼ��״Ϊ________��
(2)K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ����һ�����ܱȽ�:K____(�>����<��)Cr��������ǿ�ȱȽ�:K________(�>����<")Cr.
(3)IO3-���ӵ����幹�͵�����Ϊ_____������ԭ�ӵ��ӻ���ʽΪ________.
(4)HIO4������ǿ��HIO3,��ԭ��Ϊ_________
(5)KIO3������һ���������õķ����Թ�ѧ���ϣ�������ͼ��ʾ��
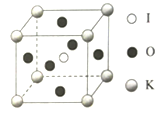
�������ⳤΪa=0.446nm,������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã�K��I�����̾���Ϊ_______nm,��K���ڵ�O�ĸ���Ϊ______�������ӵ�������ֵΪ6.02��1023����ʽ���㾧����ܶ�Ϊ_________g/cm3.(���ؼ�����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol��L-1KOH��Һ�ζ�20mL0.1mol��L-1H2A��Һ�ĵζ�������ͼ��ʾ(�����ϵ�����ΪpH)����֪pKa=-lgKa��25��ʱH2A��pKa1=1.85��pKa2=7.19������˵����ȷ������ ��

A. a��������Һ�У�2c(H2A)+c(A2-)=0.1mol/L
B. b��������Һ�У�2c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c��������Һ�У�c(K+)<3c(HA-)
D. d��������Һ��A2-��һ��ˮ��ƽ�ⳣ��Ϊ10-6.81
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ���ʼ���仯�Ŀ�ѧ����֮һ�����з����������
A. Na2CO3��NaHCO3����������
B. NaOH��Na2O�����ڼ�
C. ��������ͭ�����������ڵ���
D. ���ǡ����ᡢ�Ȼ�þ�����ڵ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com