
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是

A. 单核阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
【答案】D
【解析】X、Y、Z、W四种短周期元素,结合位置可知,W、X为第二周期元素,Y、Z为第三周期,设X的最外层电子数为x,则W的最外层电子数为x-1,Y的最外层电子数为x,Z的最外层电子数为x+1,则x+x-1+x+x+1=24,解得x=6,则W为N,X为O,Y为S,Z为Cl。
A.同主族从上到下还原性依次增强,所以S2-的还原性比O2-强,故A正确;B.N元素的气态氢化物和其最高价含氧酸盐反应生成离子化合物NH4NO3,故B正确;C. X、Y、Z最简单氢化物为H2O、H2S、HCl,非金属性越强却稳定,所以稳定性最弱的是H2S,故C正确;D.118号元素位于0族,Z是Cl位于第ⅦA族,故D错误;本题选D。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:
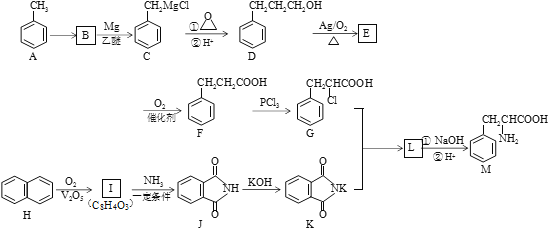
已知: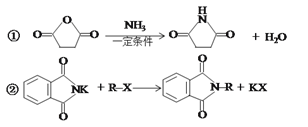
(1)A→B的反应条件和试剂是______________;化合物M的名称为________________;
(2)I→J的反应类型是______________;J分子中最多有_________个原子共平面;
(3)写出D→E反应的化学方程式________________________________________;
(4)I与乙二醇反应可生成能降解的高分子化合物N,写出该反应的化学方程式___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有两个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式________________(任写一种);
(6)请结合以上合成路线,写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸(![]() )的路线。____________________________________________________
)的路线。____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
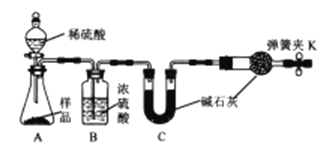
【题目】为測定某工业碱(组成为xNa2CO3·yNaHCO3)中Na2CO3的貭量分數,甲、乙、丙三名同学分別设计并完成了如下实验:
甲同学:准备称取11.40g样品利用图中装置迸行实验,反应后測定装置C中碱石灰増重5.06g。
乙同学:准确称取11.40g研细的样品,加热样品至固体完全分解,剩余固体质量为9.54g.
丙同学:准确称取11.40g样品,配成1000mL溶液,量取25.00mL溶液于锥形瓶中,加入指示剂,用0.1500mol/L标准盐酸溶被滴定至终点。完成三次平行实验后,消耗盐酸的体积平均为30.00mL。
(1)如何检查甲同学实验装置的气密性?_______________。
(2)①乙同学需要在______(填仪器名称,下同)将样品研细,在______中加热样品;
②乙同学在实验时需要将固体加热一段时间然后冷却,称量,再加热、冷却、称量,直至最后两次称量的质量差不超过0.10g,其目的是___________ 。
(3)丙同学在实验之前为了确定晶体中是否含有NaHCO3,设计了以下实验方案进行检验。
实验步骤:取少量样品于锥形瓶中加入适量蒸馏水使之溶解,加入几滴酚酞,用0.100mol/L盐酸滴定至溶液由浅红色变无色,记录消耗盐酸的体积为V1;______(填实验操作),记录消耗盐酸的体积为V2,若V2_____V1(填“<、>或=”),说明晶体中含有NaHCO3.
(4)请分析、计算后回答。
①_____同学实验结果错误,其实验失败的原因是___________。
②晶体中Na2CO3的质量分数为____________。(计算结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
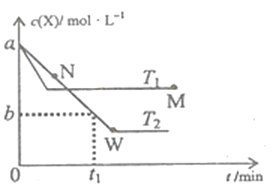
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
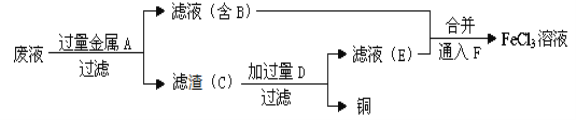
①滤渣C的化学式为_____________。
②通入F发生反应的化学方程式为_________________________。
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
a.加入足量氯水b.加入足量KMnO4溶液 c.加入少量KSCN溶液
A.ac B.cb C.ca D.abc
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:
3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________.
②反应的化学方程式中x=______.
③每生成1molFe3O4,反应转移的电子为____________mol,被Fe2+还原的O2的物质的量为______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠在氧气中燃烧生成的淡黄色的固体Na2O2,可做为呼吸面具的供氧剂
B. 将足量CO2气体通入饱和碳酸钠溶液中,会析出固体
C. 保存硫酸亚铁溶液时应加入一定量的铁粉
D. 向过氧化钠中滴入紫色石蕊试液,溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
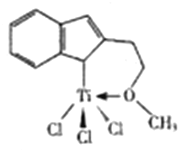
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
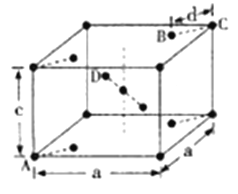
①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是
X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是

A. Z和W在该条件下有一种可能为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等。
C. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com